放射線利用技術データベースのメインページへ
作成: 2008/01/03 松本 博樹、鷲野 弘明
データ番号 :030301
PET アミロイドイメージングによるアルツハイマー病診断の研究動向
目的 :アミロイドイメージングによるアルツハイマー病診断の研究動向の紹介
放射線の種別 :陽電子
応用分野 :医学、診断
概要 :
アルツハイマー病(AD)は、老人斑・神経原繊維変化及び神経細胞の脱落の3つの病理学的所見より定義付けられる。これらを生体内で非侵襲的に感度よく検出できれば、ADの病態の分子的基盤を反映した理想的な画像診断法になる。ここでは、このような画像診断法を開発する上で有用と期待される分子イメージングの手法について説明すると共に、ADの分子イメージング研究の動向についてアミロイドイメージングを中心に概観する。
詳細説明 :
1.アルツハイマー病とは
認知症の最大の原因疾患であるアルツハイマー病(AD)は、ドイツの精神科医かつ神経病理学者であったAlois Alzheimerにより1906年に初めて報告された。彼は、健忘と見当識障害を初発症状とし抑うつ・幻覚を呈して死亡した51歳の女性患者が、①アミロイドβ蛋白質(βアミロイド)を主成分とする老人斑、②過剰にリン酸化されたタウ蛋白質を主成分とする神経原繊維変化、及び③神経細胞の脱落という特徴的な神経病理学的所見を有することを発見した。その後、この3大病理所見がADを定義付ける唯一の確定診断基準となっている。
従って、これらの病理像を生体内で非侵襲的に感度よく検出できれば、病態の分子的基盤を反映した理想的な画像診断法になるといえる。このような画像診断法を開発する上で、分子イメージングの手法が非常に有用と期待される。なおADに特徴的な局所脳糖代謝の低下パターンを18F-2-フルオロ-2-デオキシグルコース(18F-FDG)によるPETイメージングで評価する手法については、本データベースで既に紹介しているので、そちらも参照されたい。
2.分子イメージングの手法
分子イメージングという言葉は、「生体内の分子の挙動を可視化する技術」及びその応用研究を意味するが、実際にはかなり幅広い意味で用いられる。2006年に設立された日本分子イメージング学会によれば、分子イメージングとは、「生体内での分子プロセスの可視化に関する基礎的・臨床的研究及び開発された可視化手法を利用する応用研究」を示すとされている。PET(positron emission tomography)あるいはSPECT(single photon emission computed tomography)は、標識化合物を利用して生体の血流・代謝・受容体結合など生体内における分子の挙動を可視化する技術であり、広い意味で分子イメージングである。しかし、分子イメージングは、それにとどまらず、従来の臨床画像診断学や基礎生命科学におけるイメージングはもとより、複数の可視化法の融合や異なった技術分野の統合による新たなイメージング技術も包含し、生命現象をリアルタイムで可視化することを目指している。
米国では、2000年に国立生体イメージング・生体工学研究所(NIBIB: National Institute of Biomedical Imaging and Bioengineering)が設立され、また国立衛生研究所(NIH: National Institute of Health)における医学研究のロードマップ(いわゆるNIH Roadmap)の3本柱の一つに「Molecular Libraries and Imaging」(低分子化合物ライブラリーの充実と分子イメージングへの展開)が据えられるなど、国を挙げてイメージング研究が推進されている。
一方、我が国でもようやく2005年より放射線医学総合研究所及び理化学研究所を中心として分子イメージングプロジェクトがスタートした。理化学研究所(分子イメージングプログラム)は、PETを中心とした分子イメージング技術を用いて新しい分子プローブの合成と評価を行い、イメージング技術の高度化による分子動態の解析により、前臨床段階における創薬プロセスの短縮に向けた創薬候補物質の探索研究を行っている。また、放射線医学総合研究所分子イメージング研究センターは、腫瘍や精神疾患に関する基礎研究や臨床研究のほか、分子プローブの開発や放射薬剤製造技術開発、PET開発やMRIの計測技術開発など、分子イメージングの基礎研究から疾患診断の臨床研究まで幅広い研究を行っている。日本分子イメージング学会が2006年に設立され、我が国でも分子イメージング研究の幕が開いた。
分子イメージングには、多くの期待が寄せられている。例えば、生体分子の挙動から生命現象を解明することで、診断の難しい疾患の早期診断を実現し、疾患リスクの高い者を発症前に見つけ出して病気を予防し、更には創薬研究を効率化して有効な新薬の開発を加速するなど様々な可能性が注目を集めている。アルツハイマー病(AD)は、分子イメージング研究の重要なターゲットとなっており、その病態生理の解明や抜本的治療薬の創出における分子イメージングの可能性を実証する研究が行われている。なかでも近年、老人斑の主成分であるβアミロイドの脳内蓄積を画像化するアミロイドイメージングと呼ばれる画像診断法が注目を集めている。アミロイドイメージングは、既存の診断方法では困難なADの早期診断、さらにAD発症前の診断に有用と期待されている。
3. アミロイドイメージング
アミロイドイメージングに用いる標識化合物は、アミロイドのβシート構造に親和性の高い低分子化合物を短半減期の放射性同位元素(陽電子放出核種又はγ線放出核種)で標識したものである。これを静脈内に投与し、一定時間後にPETやSPECTを用いて撮像すれば、脳内のβアミロイドの分布を画像化できる。現在までに報告されたアミロイドイメージング用標識化合物のうち、臨床研究の段階まで進んだ主な化合物の構造を図1に示す。
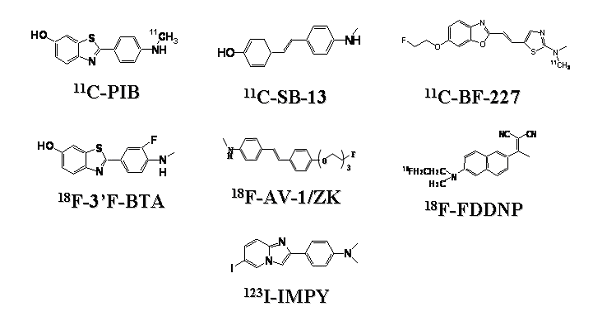
図1 臨床評価が進んでいるβアミロイド親和性化合物の構造式
多くのアミロイドイメージング用標識化合物は、コンゴーレッドやチオフラビンTといった古典的アミロイド蛍光染色試薬の化学構造を起源とする。このうちコンゴーレッド誘導体は、分子量の大きさと水溶性に起因する脳内移行性の低さから、臨床研究まで到達した化合物は報告されていない。一方、チオフラビンTは、コンゴーレッドと比較して分子量が小さく脳内移行性も期待できることから、多くの誘導体が報告されてきた。現在最も広く臨床研究に利用されている化合物は、米国ピッツバーグ大学のKlunkらによって開発された11C標識6-OH-BTA-1と呼ばれる化合物で、Pittsburgh Compound B(11C-PIB)と命名されている。この11C-PIBを用いて健常高齢者とAD患者を対象にPETイメージングを行うと(以下11C-PIB-PETという)、AD患者では前頭葉や頭頂葉を中心とする大脳皮質でPIBの顕著な集積を認める。一方、健常高齢者の多くは、大脳皮質へのPIB集積を認めない(図2参照)。この集積の差がβアミロイドの蓄積量を反映していると考えられている。図2で一見して明らかなように、健常高齢者とAD患者の違いはFDG-PETより11C-PIB-PETの方が歴然としており、11C-PIB-PETによるAD検出精度は既存の画像診断法より高いと考えられる。
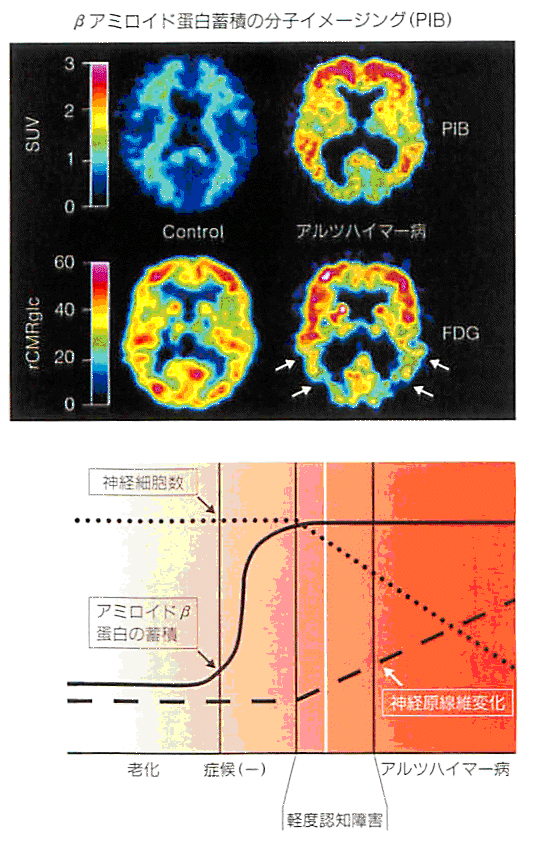
図2 11C-PIB-PETによるADの早期診断。
上側:上段が11C-PIB-PETの大脳冠状断像、下段がFDG-PETの大脳冠状断像。右列上下のイメージがAD患者の11C-PIBとFDGのPET像、左列上下が高齢健常者の同じPET像。早期AD患者では、すでにβアミロイドが蓄積している。AD患者は、11C-PIB-PETでは前頭葉及び側頭頭頂葉に高い集積を示し、FDG-PETでは特徴的な側頭頭頂葉における局所糖代謝能の低下所見を示す。この結果は、アミロイドイメージングがADの早期診断にとどまらず、根本的治療法の開発に向けた重要な知見を与える可能性を示唆している。
下側:βアミロイドの蓄積より始まるAD発症の病理過程は、臨床症状の出現よりもかなり早期に始まると考えられている。
(原論文2より引用)
チオフラビンTとは異なる骨格の標識化合物も多く報告されている。そのひとつにカリフォルニア大学(UCLA)の研究グループが開発した18F-FDDNPがあり、世界で初めて臨床研究を行った化合物である。18F-FDDNPは、脂溶性の高さなど性能の課題が指摘され、11C-PIBほど広く用いられていないが、UCLAでは臨床研究が活発に進められている。この研究グループは、ADの前駆段階と考えられる軽度認知機能障害(Mild Cognitive Impairment;MCI)の患者を対象に18F-FDDNP-PETイメージングを行い、大脳への18F-FDDNP集積増加がその後のAD移行を予言するとの結果を報告した(図3参照)。MCIで18F-FDDNP集積が増加した症例を今後観察していけば、AD発症前診断にアミロイドイメージングが有用であることを実証できる可能性がある。なお、18F-FDDNPは老人斑だけでなく神経原繊維変化に対しても高い結合性を有すると言われており、得られる画像の解釈ではこの点に留意する必要があるだろう(後述)。
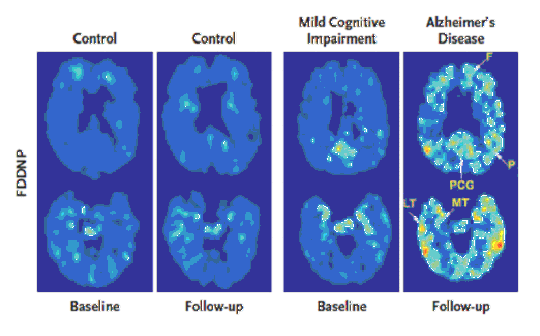
図3 健常高齢者、MCI及びAD患者における18F-FDDNP-PET画像。
左側:健常高齢者(Control)における初回(Baseline)及び約2年後(Follow-up)の18F-FDDNP-PET画像(大脳冠状断像)。健常者では、2年間に変化が認められない。
右側:一方、右の初回診察時にMCIと診断されその後ADへと進行した症例では、前頭葉で8.5% (図中Fで表示)、側頭葉後方部位で8.9% (図中LTで表示)といった集積増加が認められている。(原論文3より引用)
ペンシルバニア大学のKungらは、スチルベン誘導体である11C-SB-13を開発し、トロント大学のVerhoeffらと臨床研究を行いその有用性を報告した。Kungらは、他にも多くの18F標識アミロイド親和性化合物を開発し、オーストラリアの研究グループと共同で臨床研究を進め、米国核医学会など多数の学会で活発に報告している。Kungらは、さらにSPECT用アミロイド親和性化合物として初めてイミダゾピリジン誘導体である123I-IMPYを開発し、臨床研究成果を報告した。これは、PETだけでなくSPECTでもアミロイドイメージングが可能であること示しており、123Iよりも汎用性の高い99mTcを標識核種として用いる分子プローブの開発につながるものと思われる。我が国でも、東北大学の工藤らがPET用アミロイド親和性化合物である11C-BF-227を開発し、その臨床的有用性を検証した(図4参照)。
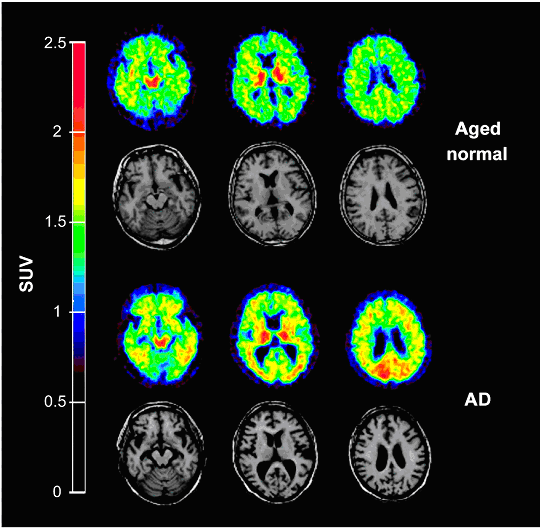
図4 健常高齢者及びAD患者における11C-BF-227-PET像とMRI像。
11C-BF-227投与後20分から40分のPET加算データに基づくSUV画像及び位置をあわせたMRI画像(いずれも大脳冠状断像)。上段は健常高齢者(70歳女性)、下段はAD患者(68歳女性)。下段のAD患者では、11C-BF-227の有意な集積増加が見られる。(原論文4より引用)
4. タウのイメージング
ADでは、タウ蛋白質の凝集物である神経原繊維変化も脳内に出現することが特徴である。先に述べたように、18F-FDDNPは老人斑のみでなく神経原繊維変化に対しても高い結合性を有すると言われている(図5参照)。東北大学の岡村らも、神経原繊維変化に対して比較的結合選択性の高い化合物を見出している。AD・前頭側頭葉型認知症・ピック病など神経原繊維変化の蓄積を伴う神経変性疾患はタウオパチーと総称されているが、タウ蛋白質に選択的に結合する標識化合物が見出されれば、タウオパチーの診断や病態解明に有用と期待されている。
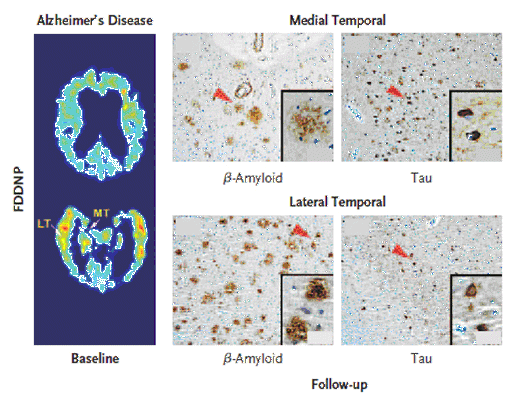
図5 AD患者における18F-FDDNP-PET像と病理所見。
左側:AD患者における18F-FDDNP-PETの結果をLoganグラフ解析し、小脳を参照領域として脳局所の分布容積比(DVR)を求め、それを画像化した。LT:側頭葉外側、MT:側頭葉内側。
右側:18F-FDDNP-PETスキャンの14ヶ月後に亡くなった患者の脳組織標本を用いた免疫組織染色像。病理組織染色は、抗βアミロイド(1~42)抗体と抗リン酸化タウ蛋白質抗体を使用した。上段は側頭葉内側、下段は側頭葉外側の病理組織像で、矢印先部分の強拡大像が右下に挿入されている。18F-FDDNPは、タウの多い領域にもアミロイドの多い領域にも集積していることから、双方に結合していると考えられている。(原論文3より引用)
5. 炎症のイメージング
ミクログリアは脳内の免疫反応などを担当する細胞であり、ADをはじめとする種々の神経変性疾患ではミクログリアの活性が上昇することが知られている。ADの場合、この細胞の過剰な活性化は脳の損傷を加速すると考えられている。活性化ミクログリアは末梢性ベンゾジアゼピン受容体を多く発現しており、これに特異的に結合する化合物はミクログリアの活性を画像化する有用な分子プローブとなる。末梢性ベンゾジアゼピン受容体に特異的に結合する化合物PK11195を11Cで標識した11C-PK11195は、英国Hammersmith病院のCagnin及びBrooksらを中心に研究され、ADやパーキンソン病など多くの神経変性疾患患者の脳における炎症反応の画像化が試みられた(図6参照)。
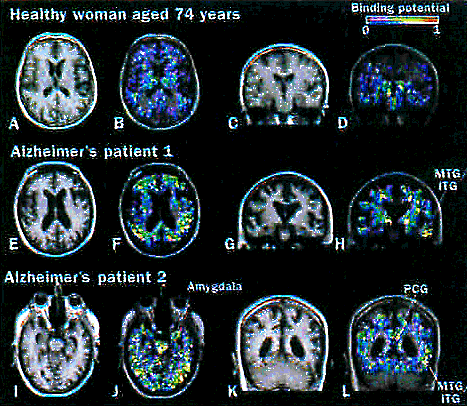
図6 健常高齢者及びAD患者における11C-PK11195-PET像とMRI像。
上段:健常高齢者における11C-PK11195-PET及びMRI T1強調像。図A,C:MRI T1強調画像、図B,D:PET-MRI重ね合わせ画像。健常高齢者では大脳皮質に有意な11C-PK11195の集積は認められない。
中下段:ADの重症例(中段図E~H)及び中等度症例(下段図I~L) における11C-PK11195-PET及びMRI T1強調像。図E,G,I,K:MRI T1強調画像、図F,H,J,L:PET-MRI重ね合わせ画像。AD症例では、側頭葉に顕著な集積が認められる。(原論文6より引用)
放射線医学総合研究所と民間企業が共同で開発した末梢性ベンゾジアゼピン受容体特異的な18F-FE-DA1106についてもユニークな研究が進められている。放射線医学総合研究所の樋口らは、タウの遺伝子異常を導入したトランスジェニックマウスを用いた研究で、加齢に伴って脳の海馬等において神経細胞の死滅が起こり、組織の萎縮が生じることを確認した。このマウスの脳を18F-FE-DA1106を用いてPETで画像化したところ、大脳皮質・海馬において委縮が認められる以前の段階でトレーサーの結合増加が認められ、ミクログリアの活性化が早期に起こることが定量的に示された。また、このマウスに免疫抑制剤FK506を投与してミクログリアの活性化を抑えたところ、タウ蛋白質の蓄積や海馬の萎縮が抑えられることが確認された。放射線医学総合研究所では、この標識化合物をヒトPET検査に応用することをはじめており、今後認知症の診断薬開発に貢献すると考えられる。また、ミクログリアの活性化を抑えることで神経変性が抑制される可能性が示されたため、認知症の治療薬開発に大きな展望をもたらすものとも期待される。ミクログリアの活性制御に特化した薬剤の開発を推進することにより、将来的に認知症の治療法を確立できる可能性もあり、その際にミクログリアの活性レベルをPETで定量することで、臨床でも治療効果の評価が行えるようになるかもしれない。
6. バイオマーカーとしてのアミロイドイメージング:ADNIの取り組み
ADの病態・病因に関する研究の進展とともに、ADの本質的過程に作用しその進行を遅延あるいは停止させる治療薬の開発が進んでいる。ADの真の病因は未だ不明であるが、現在創薬の理論的根拠として最も広く信じられているのがアミロイド仮説である。ADの脳に蓄積するβアミロイドをADの原因物質と考えるアミロイド仮説は、βアミロイド蓄積がADに特異的であること、ADの脳病変として最初期に出現することなどを根拠として提唱された。家族性ADの病因遺伝子変異がβアミロイド蓄積を促進するという知見が、この仮説を支持している。
βアミロイドを標的とする治療法は、ADの病変の最上流に作用するものであるため、その効果を最大化するにはADの早期診断~早期治療開始が本質的に不可欠である。ADの臨床的前駆段階と考えられる健忘性軽度認知障害(amnestic MCI)の段階でもADの病理は相当に進行していることから、非侵襲的なADの発症前診断法の確立と普及こそが、効率的な根本的治療・予防の実現には欠かせない。PETを用いたアミロイドイメージングは、この目的を達成する最も有力な手段と考えられる。さらに、根本的治療薬の効果は短期的な症状の改善をもたらさないと考えられ、従来の臨床症状を指標とする診断方法では、開発される治療薬の有効性を十分検証できない懸念がある。代替的な指標(サロゲートマーカー)を用いた客観的評価法の確立が急がれる。現時点での代替指標としては、FDG-PETによる脳代謝評価などの脳イメージング、MRIを用いた脳萎縮の経時的・定量的評価、血液・脳脊髄液の生化学的マーカーなどの組み合わせが重要となる。米国では、画像・生化学マーカー・臨床評価を総合し最も効果的かつ客観的なMCI及びAD評価法を確立することを目指す大規模臨床研究「アルツハイマー病神経イメージング先導研究(ADNI)」が進行中である。現在までにほぼ800例の被験者の登録を終え、追跡調査の期間に入っている。我が国でも2007年秋よりJ-ADNIが始動し、600例の登録を目指している。欧州やオーストラリアでも同様の臨床研究が計画され、AD早期診断の世界標準化が図られようとしている。これらの努力は根本治療・予防薬の開発に不可欠であると同時に、AD診療のレベル向上に役立つであろう。
原論文1 Data source 1:
Imaging brain amyloid in Alzheimer's disease with Pittsburgh Compound-B.
Klunk WE, Engler H, Nordberg A, Wang Y et al.
Department of Psychiatry, PET Facility, University of Pittsburgh, 200 Lothrop Street, Pittsburgh, PA 15213-2582, USA.
Ann Neurol 2004: 55;306-319.
原論文2 Data source 2:
創薬のための分子イメージング
渡辺恭良
理化学研究所、大阪市立大学
BRAIN and NERVE 2007: 59(3);209-214.
原論文3 Data source 3:
PET of brain amyloid and tau in mild cognitive impairment.
Small GW, Kepe V, Ercoli LM, Siddarth P et al.
Department of Psychiatry and Biobehavioral Sciences and the Semel Institute for Neuroscience and Human Behavior, David Geffen School of Medicine at the University of California, Los Angeles, USA. gsmall@mednet.ucla.edu
N Engl J Med 2006: 355;2652-63.
原論文4 Data source 4:
2-(2-[2-Dimethylaminothiazol-5-yl]ethenyl)-6- (2-[fluoro]ethoxy) benzoxazole: A novel PET agent for in vivo detection of dense amyloid plaques in Alzheimer's disease patients.
Kudo Y, Okamura N, Furumoto S, Tashiro M et al.
Tohoku University Biomedical Engineering Research Organization, Sendai, Japan.
J Nucl Med 48, 553-561, 2007.
原論文5 Data source 5:
In-vivo measurement of activated microglia in dementia.
Cagnin A, Brooks DJ, Kennedy AM, Gunn RN et al.
MRC Cyclotron Unit, Imperial College, Faculty of Medicine, Division of Neuroscience and Psychological Medicince, Hammersmith Hospital, London, UK.
The Lancet 2001: 358;461-467.
参考資料1 Reference 1:
Quinoline and benzoimidazole derivatives: Candidate probes for in vivo imaging of tau pathology in Alzheimer's disease.
Okamura N et al.
J Neurosci 2005: 25;10857-10862
参考資料2 Reference 2:
In-vivo imaging of Alzheimer's disease beta-amyloid with [11C]SB-13 PET.
Verhoeff NP et al.
Am J Geratr Psychiatry 2004: 12;584-595.
参考資料3 Reference 3:
Use of 123I-IMPY SPECT to differentiate Alzheimer's disease from controls.
Newberg AB et al.
J Nucl Med 2006: 47;78P.
参考資料4 Reference 4:
Synapse loss and microglial activation precede tangles in a P301S tauopathy mouse model.
Yoshiyama Y et al.
Neuron 2007: 53;337-351.
参考資料5 Reference 5:
アルツハイマー病の予防・治療 根本的治療薬へのアプローチ
岩坪 威
CLINICIAN 2006: 553;983-987.
参考資料6 Reference 6:
アルツハイマー病と関連疾患の画像診断 その未来
岡村 信行
CLINICIAN 2006: 553;932-937.
参考資料7 Reference 7:
脳内アミロイドの分子イメージング
小野正博
BRAIN and NERVE 2007: 59(3);233-240.
参考資料8 Reference 8:
独立行政法人 放射線医学総合研究所 プレス発表 平成19年2月2日
http://www.nirs.go.jp/news/press/2006/02_02.shtml
キーワード:画像診断、ポジトロンエミッショントモグラフィー、 シングルフォトンエミッショントモグラフィー、 放射性医薬品、18F-2-フルオロ-2-デオキシグルコース、アルツハイマー病、認知症、痴呆、軽度認知障害、健忘性軽度認知障害、老人斑、神経原繊維変化、βアミロイド、タウ蛋白質、アルツハイマー病神経イメージング先導研究
diagnostic imaging, positron emission tomography, PET, single photon emission computed tomography, SPECT, radiopharmaceutical, 18F-2-fluoro-2-deoxyglucose, 18F-FDG, 11C-PIB, 11C-BF-227, 18F-FDDNP, 18F-3'F-BTA, 18F-AV-1/ZK, 11C-PK11195, 123I-IMPY, Alzheimer's disease, dementia, mild cognitive impairment, MCI, amnestic MCI, senile plaque, neurofibrillary tangle, β-amyloid, tau-protein, Alzheimer's Disease Neuroimaging Initiative, ADNI
分類コード:030502, 030301, 030403
放射線利用技術データベースのメインページへ




