作成: 2006/01/03 鷲野 弘明
データ番号 :030274
FDG-PETによるアルツハイマー病の診断
目的 :FDG-PETによるアルツハイマー病の診断の現状の紹介
放射線の種別 :陽電子
応用分野 :医学、診断
概要 :
アルツハイマー病(AD)は、原因不明の進行性の中枢変性疾患であり、大きな社会問題となっている。ADには疾患特異的かつ客観的な診断基準がないため、その臨床診断においてはCT・MRI・核医学(脳血流SPECT)等の画像診断情報が有用である。近年臨床的に普及したFDG-PETは、ADの診断にも有用であることが知られる。ここでは、ADという病気について一般的に紹介し、FDG-PETによる診断の意義について説明する。
(2005年に登場した認知症という言葉は、まだ専門的な医学用語あるいは医学表現に用いられる用語として定着していない。よって本解説では、従来通り痴呆という言葉を使用する。)
詳細説明 :
1. FDG−PETによるアルツハイマー病の診断
今日アルツハイマー病といわれる痴呆性疾患を初めて報告したのは、ドイツの精神科医かつ神経病理学者であったAlois Alzheimerである。彼は、健忘と見当識障害を初発症状とし抑うつ・幻覚を呈して死亡した51歳の女性患者が特徴的な神経病理学的所見を有することを発見し、1906年南西ドイツ精神医学会で新たな痴呆性疾患として報告した。彼の師であるクレペリンは、1910年この疾患に「アルツハイマー病」という病名を与え、今日定着するに至った。当初、アルツハイマー病は65歳未満の初老期に発症する痴呆症状と特徴的病理所見を示す病気をさし、65歳以降の老年期に発症する場合はアルツハイマー型老年痴呆(senile dementia of the Alzheimer type)呼んで区別していた。しかし、発症年齢による区別は人為的であり両疾患の本質は同じとの認識が受け入れられるに至り、今日では両者を合わせてアルツハイマー病(AD)と呼んでいる。
ADは、後述するように疾患特異的所見に乏しいため、臨床診断は様々な疾患の可能性を否定した上で行うのが原則である。しかし、ADが中枢変性疾患の一般的特徴である脳の萎縮や血流低下・代謝機能の低下を示すことに着目し、1980年代よりCT・MRI・SPECT・PETで診断する研究が行われてきた。これらの画像診断の位置付けは、2005年に日本老年精神医学会がまとめた「アルツハイマー型痴呆の診断・治療・ケアガイドライン:画像診断ガイドライン」で提案され、臨床現場では日常検査に利用されている。
18F-2-フルオロ-2-デオキシグルコース(18F-FDG)によるPETイメージング(以下ではFDG-PETと省略)は、細胞のブドウ糖代謝を画像化し、ADにおける大脳皮質の神経細胞密度の低下あるいは代謝機能の低下を診断し得るモダリティである。1970年代後半に18F-FDGが開発されると、1980年初めよりFDG-PETによるAD研究が開始された。その後AD研究は盛んに行われて大きな成果を挙げ、FDG-PETのよるADの画像診断は従来の臨床診断にまさる診断精度を有する診断法と認識されるに至った。今日ではFDG-PETによる研究の焦点は、軽度認知障害(mild cognitive impairment: MCI)にある患者が近い将来ADを発症するかどうか予測する方向に向かいつつある。
FDG-PET検査は、我国では悪性腫瘍、脳・心臓の虚血〜梗塞、てんかんを対象に2002年より保険適用となり、米国ではさらにADと前頭側頭型痴呆(frontotemporal dementia: FTD)の鑑別診断が保険適用となっている。我国では、2005年より18F-FDG注射液が診断剤として市販され、PET装置を保有する病院ではFDG-PETは日常検査として実施されている。18Fは、サイクロトロンで生産される物理的半減期110分の放射性核種であり、ポジトロン(β+)を放出する。β+は、反粒子で電子と一緒に消滅する際に510keVのγ線を2本反対方向に放射し、この2本のγ線放射を同時に捕らえて画像化するのがポジトロンエミッショントモグラフィー(PET)である。PETは、核医学画像診断装置の中では定量性や空間分解能に優れている。
2. アルツハイマー病の疫学
65歳以上で痴呆を呈する老人の統計は、厚労省が発表した「我国の精神保健福祉:平成12年度版」によれば表1のようである。この表から明らかなように、過去において平均寿命が延び、65歳以上の老人人口の増大に伴って痴呆性老人の数は急激に増加し、その勢いは将来も続くことが予想されている。
表1 65歳以上の痴呆性老人数の推移とその老年人口に対する痴呆性老人の割合(有病率)
| 年次 |
患者推計数(万人) |
有病率(%) |
| 1990 |
101 |
6.8 |
| 1995 |
125.9 |
6.9 |
| 2000 |
155.8 |
7.2 |
| 2005 |
188.8 |
7.6 |
| 2010 |
225.6 |
8.1 |
| 2015 |
262.2 |
8.4 |
| 2020 |
291.6 |
8.9 |
痴呆状態は、後述するようにAD以外にも脳梗塞・腫瘍・薬物・正常圧水頭症・他の中枢変性疾患などで惹起される。よって、AD診断基準の主観性・統計誤差・誤診の可能性等を考えると、痴呆性老人の疫学調査で示された患者推計数のうちどれくらいがADなのか正確につかむのは難しい。様々な統計に基づく推定値が報告されているが、従来我国ではおおよそAD:20%、脳血管障害を合併したAD:40%、血管性痴呆:20%、その他の疾患(レビー小体型痴呆・前頭側頭型痴呆等):20%程度と推定されてきた。しかし、欧米諸国ではADの比率は日本よりかなり高いことが知られ、我国でも全痴呆患者に占めるADの割合は現在40〜50%に増加していると考えられる。
3. アルツハイマー病の病理像及び画像診断
(1) アルツハイマー病の病理像
成人の大脳は、老化とともに多少とも萎縮していくが、ADでは萎縮の進行速度と程度が著しく、通常1,300gほどある脳重量が1,000g以下まで減少する。大脳皮質はびまん性に萎縮し、通常5mmほどある厚みは2mmにまで減少する。皮質下白質も萎縮し、脳回は狭くなる。萎縮の程度は部位によって異なり、前頭葉と側頭葉で顕著に見られ、特に側頭葉内側の海馬と海馬傍回は強い萎縮を示す。AD初期の記憶障害や見当識障害は、記憶の場である海馬に病変が初発することに起因する。
萎縮した脳組織に特徴的な病理所見は、神経細胞の萎縮・消失、神経細胞内の神経原繊維変化(neurofibrillary tangle: NFT)の出現、βアミロイドを主成分とする老人斑(senile plaque: SP)の出現である。図1にSP やNFTの光学顕微鏡像を、図2にAD患者の大脳において神経細胞の消失やNFT・SPの出現する領域を示す。特徴的病理所見が現れる領域が特に前頭葉と側頭葉に集中するのがADの特徴であり、これが後述するように画像診断の根拠となる。
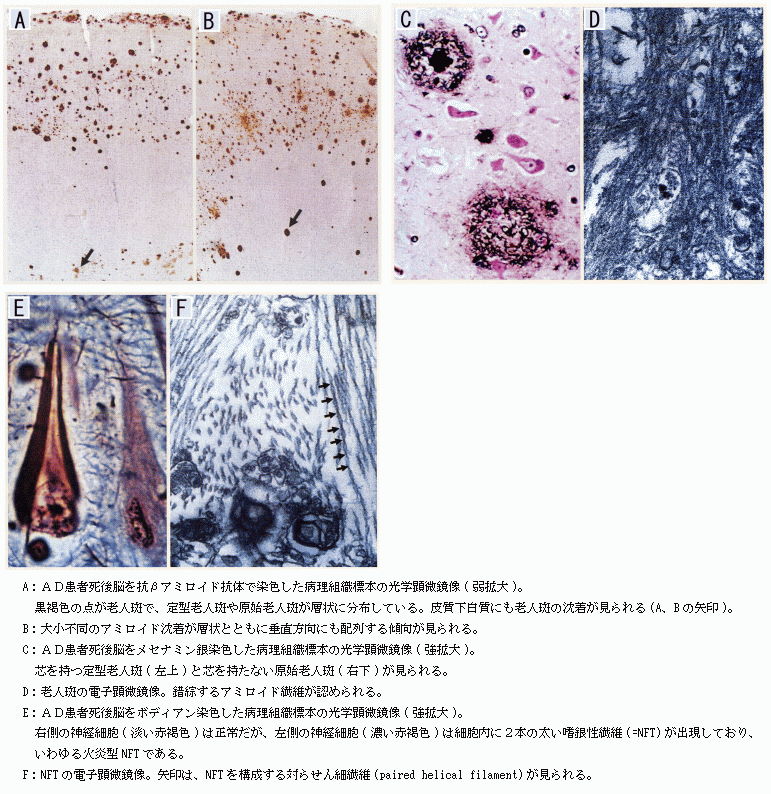
図1 ADにおける神経原繊維変化と老人斑の光学顕微鏡像(原論文1より引用)
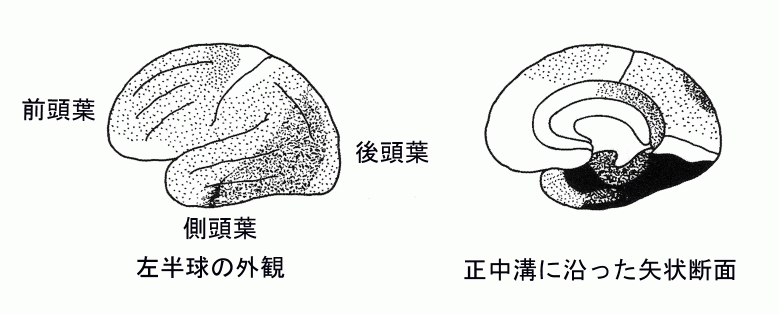
図2 ADにおける大脳の病理学的変化の分布
ADにおける脳局所の病理学的変化の度合いを点描で示した。薄い点描は軽度から中等度の変化を示す領域、濃い点描から黒塗りは重度の病理学的変化を示す領域。(原論文2より引用)
(2) 画像診断の原理
頭部CTや脳MRIは、頭蓋内占拠性病変や脳局所の萎縮を形態学的に捉えることによって診断する。形態学的診断は、特に他の類似病変との鑑別に役立つ。ただし、形態学的な異常が顕著ではない早期ADでは、CT・MRIによる診断は困難である。
脳血流SPECTは、123I-IMP注射液・99mTc-ECD注射液・99mTc-HMPAO注射液を用いて脳血流を測定する核医学診断であり、基本的に脳局所血流の低下パターンよりADを診断する。側頭葉内側や前頭葉の神経細胞が脱落し代謝レベルが低下すると、その領域の脳血流は低下すると考えられる。ADは、脳血流の低下パターンをそのまま読影するか、画像統計解析することで診断される。
画像統計解析(3D-SSP法、eZIS法等)とは、まず大規模な健常人の脳血流イメージをデータベース化しておき、個々の患者の脳血流イメージをデータベースのイメージと比較するものである(図4参照)。これにより、患者の脳の各領域において健常人の標準化された局所血流と比較して相対的にどれほど血流低下が起きているかが分かる。ADの場合、脳血流SPECT像を総合的な臨床診断を基準として画像統計解析なして読影すると、診断能は感度・特異度ともに80〜90%程度であるが、画像統計解析することで感度:91〜94%、特異度:86〜97%に上昇する(原論文3)。
18F-FDGは、細胞のブドウ糖代謝を反映して細胞内に取り込まれる。正常な成人の脳では、神経細胞の数は脳の全細胞数の10%程度で、それ以外はグリア細胞などが占める。しかし、脳全体のブドウ糖消費の過半は、代謝活動が盛んな神経細胞によって行われる。18F-FDGの場合、正常な脳組織ではその取り込みの80%は神経細胞によるといわれる。従って、神経細胞の密度やエネルギー代謝の低下は、そのまま18F-FDGの取り込み低下となって画像上に現れる。FDG-PETは、神経細胞数の低下や神経細胞自身の代謝活性の低下に相関した画像を与えると考えられる。早期ADの画像診断は、CT・MRIではほぼ不可能、脳血流SPECTでも難しい。しかし、FDG-PETでは可能との文献報告があることは注目に値する。
(3) アルツハイマー病の発症メカニズム
ADの発症機構は、現在のところ完全には理解されていない。図3は、現在支持されているADの発症機構に関する仮説(アミロイド仮説)を示す。これは、老人斑の構成成分であるβ-アミロイドが神経細胞死の原因ではないかとする考え方である。AD患者と正常老人との間ではSPの出現量には大きな差がある、SPがまず最初に出現しNFTはその後で出現する、神経細胞死はNFT出現の頃から始まる、といった知見が仮説の基礎となっている。
ADの発症と症状発現には、遺伝子異常が関与していることが明らかとなっている。常染色体優性遺伝の家族性早発性ADを引き起こす遺伝子変異としては、Amyloid precursor protein(APP)遺伝子、presenilin 1遺伝子、presenilin 2遺伝子の変異が知られている。また、近年ADの原因ないし危険因子としてApolipoprotein Eの遺伝子サブタイプε4(ApoEε4)が注目されている。
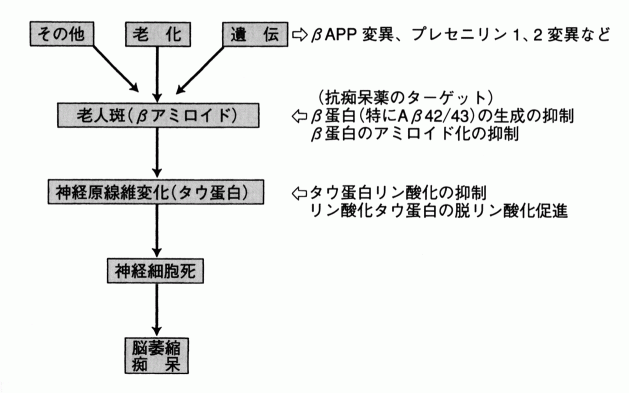
図3 ADの発症機構:アミロイド仮説(原論文2より引用)
SPの出現に始まり神経細胞死に至るプロセスは、ADの臨床症状が出現するかなり前から始まり(10年以上前から始まる?)、神経細胞消失による脳の機能低下が一定レベルに至ると臨床症状が出てくると推測されている。また、臨床症状発現後もこうした病理学的変化は不可逆的に進行し、ADの病態はそれによって重症化する。ADという病気の本質は、進行性に神経細胞が脱落して脳の高次機能が失われ、患者が社会生活を送る能力を喪失する点にある。
4. アルツハイマー病の臨床診断
ADは疾患特異的なマーカーや検査異常がないので、臨床診断は基本的に除外診断であり(=類似の疾患をすべて除外したあとでADと診断する消去法的診断)、確定診断は死後脳の病理組織所見による。即ち、現実の臨床現場では、患者を前にして直接的な病理学的証拠に基づいて診断することは不可能であり、現実には様々な臨床症状・検査結果・画像診断所見をもとに診断する。今日ADの臨床診断基準として広く用いられているものに、NINCDS-ADRDA、ICD-10、DSM シリーズのIII R、IV、IV TR等がある。最もよく知られている診断基準DSM-IVの概要を例に示すと以下のようになる(原論文1)。
<ADの診断基準:DSM-IV要約>
A:多彩な認知欠損の発現で、それは以下(1)、(2)の両方より明らかにされる。
(1) 記憶障害
(2) 以下の認知障害のひとつ(またはそれ以上):失語、失行、失認、実行機能の障害
B:基準A(1)及びA(2)の認知欠損は、その各々が社会的・職業的機能の著しい障害を引き起こし、病前の機能水準から著しい低下を示す。
C:経過は緩やかな発症と持続的な認知の低下により特徴付けられる。
D:基準A(1)及びA(2)の認知欠損は、以下のいずれによるものでもない。
(1) 記憶や認知に進行性の欠損を引き起こす中枢神経系疾患
(2) 痴呆を引き起こすことが知られている全身性疾患
(3) 物質誘発性の疾患
E:その欠損は、せん妄の経過中のみ現れるものではない。
F:その障害は、他の第一軸の疾患(例えば大うつ病性障害・統合失調症)ではうまく説明できない。
AD診断基準はいずれも主観的判断の要素が入り込む余地を残すものであり、診断をサポートする客観的証拠を提供する画像診断は、今日AD診断では欠かせない。
AD診断の一般的な流れは、おおよそ次のとおりである:
i) 来院した患者の病歴を本人及び家族から聴取し、身体的・神経学的な診察を行う。この時点で顕在化した大うつ病・せん妄や意識障害は除外される。
ii) 上述のAD診断基準に相当する症状が疑われるとき、神経心理学的スクリーニング検査(改訂長谷川式簡易知能評価スケール(HDS-R)や日本語版MMSEテスト)を行い、患者の認知機能低下を評価する。ここで検査結果が規定のカットオフ値を下回れば、頭部CT・脳MRIによる画像診断へと進む。
iii) 頭部CT・脳MRIでは、頭蓋内占拠性病変(脳腫瘍・悪性リンパ腫・慢性硬膜下血腫等)、血管病変(脳梗塞・脳血管性痴呆)、頭部外傷の有無を診断する。この時点でこれらの疾患が除外される。
iv) さらに、必要に応じて血液検査・毒物検査・胸部レントゲン・腰椎穿刺等を施行する。この時点で甲状腺機能低下症・悪性貧血・薬物中毒・肺がん・脳炎・髄膜炎などが除外される。
v) まだ確定診断に至らない場合、記憶障害が何らかの中枢変性疾患に起因すると考えられる。さらに鑑別診断に進む場合、神経学的症候及びMRIにおける脳萎縮(海馬萎縮)所見を参考に脳血流SPECT検査を行う。ここで脳血管性痴呆・AD・前頭側頭葉変性症(FTLD)・レビー小体型痴呆(DLB)等の鑑別診断が行われる。
従来、ADは有効な治療法や治療薬のない疾患だったが、近年コリンエステラーゼ阻害剤であるドネペジル(アリセプトTM)が発売され、さらに様々なAD治療薬の臨床試験が精力的に進められている(米国では2005年に65品目のAD治療薬が臨床試験段階にあった)。こうしたことから、ADを積極的に診断することは、AD治療を適切かつ早期に開始するためには必須といえる。
5. アルツハイマー病の画像診断:脳血流SPECT検査
脳血流SPECTによるADの鑑別診断の例を図4に示す。これは、AD、DLB及びFTDの脳血流SPECTの画像統計解析による鑑別診断の可能性を示したものである。各疾患の脳血流SPECT像は特徴的な局所血流低下パターンを持っており、その違いに着目することでこれらの疾患の鑑別を行いうることが示されている。
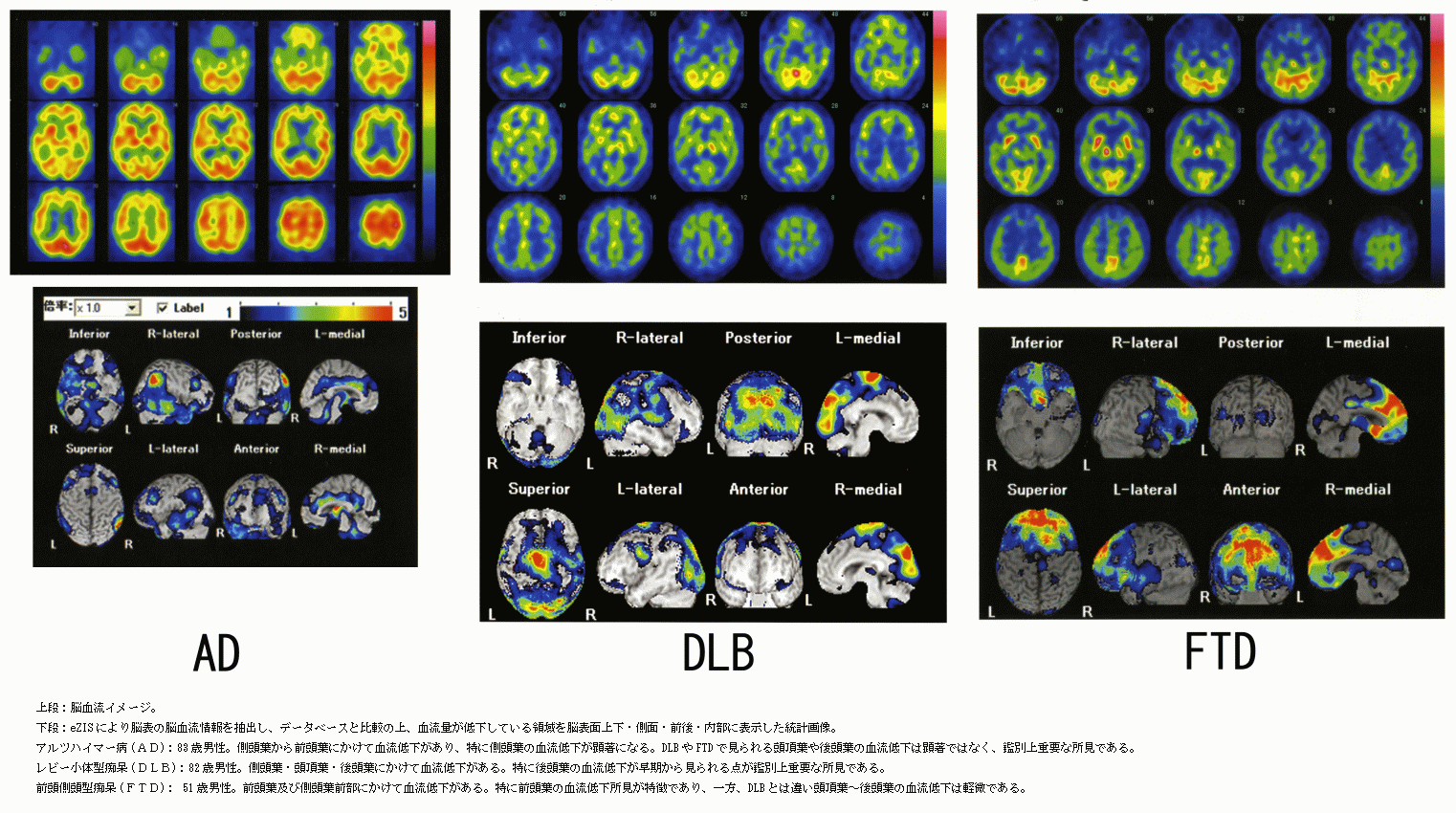
図4 脳血流SPECTの画像統計解析法によるAD、DLB及びFTDの診断(原論文3より引用)
6. FDG-PETによる軽度認知障害〜早期アルツハイマー病の診断
脳血流SPECTとFDG-PETのどちらが早期ADの診断に優れるか、今のところ直接比較した研究はない。しかし、一部の研究者は、FDG-PETの方が早期ADの診断に優れるとの感触を持っているようである。ADにおける典型的なFDG-PET所見は、後部帯状回・楔前部・頭頂側頭連合野から集積低下が始まり、進行すると前頭連合野に及ぶ点である(図5参照)。若年発症の早期ADでは、MRIでほとんど萎縮が認められなくても、FDG-PETでは歴然とした上記の異常を指摘できることが多く、FDG-PETは他の画像診断法より早期にADを検出できる点で有用といえる。
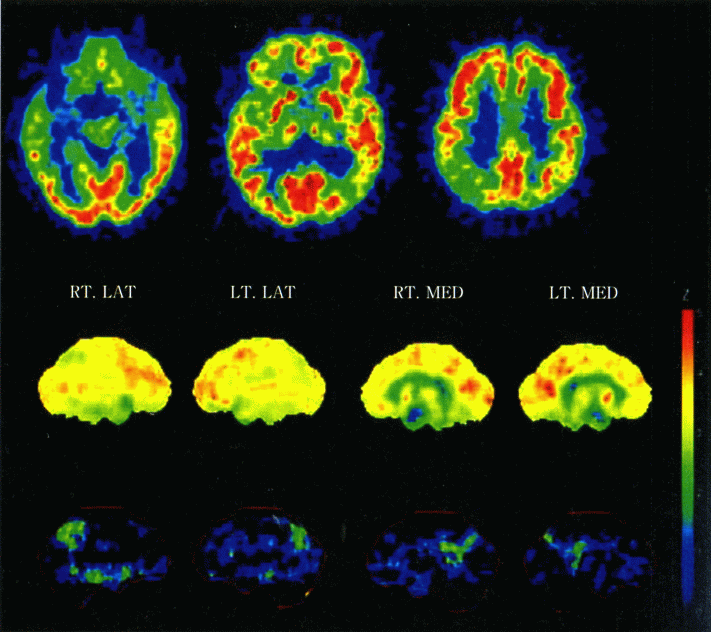
図5 初期AD患者のFDG-PET像及び3D-SSPによる統計画像
上段:FDG-PETによる脳のブドウ糖代謝画像。この患者では、両側頭頂側頭葉、後部帯状回・楔前部のブドウ糖代謝が低下している
中段:3D-SSPにより脳表の情報を抽出し、FDG集積量を脳表面の左右側面及び内部に表示したFDG-PET像。
下段:3D-SSPにより中段の像を統計処理し、正常人データベースと比較して有意に低下している領域をZスコアで表示したもの。両側頭頂側頭葉、後部帯状回・楔前部のブドウ糖代謝低下が容易に指摘できる。(原論文4より引用)
近年非常に注目されているのは、軽度認知障害(MCI)を示す患者群の存在である。MCIとは、健忘を主とする軽度の認知機能低下があるものの痴呆ではない疾患概念を指す(国際的に合意された診断基準はない)。このMCI患者の中にはやがてADに至る患者が高率に含まれていることが分かっており、ADへと至る高リスク患者群である。MCI患者がADに移行する確率については様々な報告があるが、恐らく年間1割程度ではないかと推測される。このMCI患者をFDG-PETで検査すると、明らかにAD様の異常所見を呈する患者がいることが知られている。
MCI患者の予後に関するDrzezgaらの研究成果を紹介する。彼らは、神経心理学的検査(MMSEテスト)、AD危険因子ApoE(ε4)など一定の基準を満たすMCI患者30名を集めてFDG-PETで検査し、15ヵ月後にFDG-PETを含む検査を再び行ってADに移行した患者の有無を調べた。驚くべき結果を以下表2に示す。
表2 MCI患者におけるFDG-PET検査の結果と16ヵ月後の病状の相関性について
(原論文5より引用。 Reprinted by permission of Society of Nuclear Medicine from:
Drzezga A, Grimmer T, Riemenschneider M, Lautenschlager N, Siebner H, Alexopoulus P, Minoshima S, Schwaiger M, Kuruz A. Prediction of individual clinical outcome in MCI by means of genetic assessment and 18F-FDG-PET. J Nucl Med 2005; 46:1625-1632. Table 1)
| 試験開始後16ヶ月時点の状態 ⇒ |
AD*) |
非AD*) |
p-value |
| 数 |
12名 |
18名 |
|
| 男女別の数 |
男:6、女:6 |
男:8、女:10 |
0.94 |
| 年齢/試験開始時 |
74.7±4.7 |
67.6±8.2 |
0.01 |
| MMSEスコア/試験開始時 |
25.9±2.1 |
27.6±1.5 |
0.02 |
| MMSEスコア/15ヵ月後 |
22.6±2.5 |
27.2±2.2 |
<0.001 |
| ApoE(ε4) |
ε4 positive |
9 |
8 |
0.2 |
| ε4 negative |
3 |
10 |
| FDG-PET/試験開始時 |
典型的AD |
11 |
2 |
<0.001 |
| 非典型的AD |
1 |
16 |
| MCI症状の継続期間(年) |
3±1.7 |
2.3±2.2 |
0.35 |
| 教育期間(年) |
12.4±3.7 |
11.1±3.2 |
0.31 |
*) 「AD」とはAD診断基準を満たしたMCI患者、「非AD」とは基準を満たさずADとは診断されなかったMCI患者。
試験開始時点でMCIと判断された30名のうちFDG-PETでAD様の所見を示したものは13名、非AD様の所見を示したものが17名であった。そして、16ヵ月後AD所見を示した13名からADに移行した者は11名、一方非AD所見を示した18名からADに移行したものはわずか2名であった。FDG-PETは、MCI患者のAD移行をかなりの精度で予測しうることが明らかとなった。
現在、世界中の大手製薬企業はAD治療薬の研究開発を行っており、近い将来ADの治療薬、恐らくはADの進行を止めるか遅延させる治療薬が出現するものと思われる。ADの予防的治療が可能となれば、そのような治療対象となる高リスク患者あるいはそれ以前の状態にある患者予備軍を的確にスクリーニングする検査が必要となる。FDG-PETはそのような検査に利用しうることが示唆される。
コメント :
FDG-PETによるAD診断は、我国ではまだ保険適用となっていない。早期の保険適用が望まれる。
原論文1 Data source 1:
最新医学別冊 新しい診断と治療のABC No.22/神経3 −アルツハイマー病
田平 武 編集
最新医学社, 2004
原論文2 Data source 2:
よくわかるアルツハイマー病 −実際に関わる人のために−
中野 今治, 水澤 英洋 編集
永井書店, 2004
原論文3 Data source 3:
アルツハイマー型痴呆の診断・治療・ケアガイドライン:画像診断ガイドライン
中野 正剛
老年精神医学雑誌 2005; 16(4) 増刊号-I:pp.20-40
原論文4 Data source 4:
臨床編 VIII. 痴呆の診断/画像検査(ニューロイメージング)−機能画像検査/PETによる痴呆分類
石井 一成, 森 悦朗
日本臨床 2003; 61 増刊号9:pp.473-478
原論文5 Data source 5:
Prediction of individual clinical outcome in MCI by means of genetic assessment and 18F-FDG-PET
Drzezga A, Grimmer T, Riemenschneider M, Lautenschlager N, Siebner H, Alexopoulus P, Minoshima S, Schwaiger M, Kuruz A
J Nucl Med 2005; 46:1625-1632
参考資料1 Reference 1:
Heterogeneity of brain glucose metabolism in mild cognitive impairment and clinical progression to Alzheimer disease
Anchisi D, Borroni B, Franceschi M, et al.
Arch Neurol 2005; 62:1728-1733
参考資料2 Reference 2:
Differentiation of Alzheimer's disease from dementia with Lewy bodies utilizing positron emission tomography with [18F]fluorodeoxyglucose and neuropsychological testing
Gilman S, Koeppe RA, Little R, et al.
Exp Neurol 2005; 191 Suppl 1:S95-S103
参考資料3 Reference 3:
MCI conversion to dementia and APOE genotype: a prediction study with FDG-PET.
Mosconi L, Perani D, Sorbi S, et al.
Neurology 2004; 63:2332-2340
参考資料4 Reference 4:
Differences in cerebral glucose metabolism between frontotemporal lobar degeneration and Alzheimer's disease.
Poljansky S, Ibach B, Vogel M, et al.
Psychiatr Prax 2004; 31 Suppl 1:S73-75
参考資料5 Reference 5:
Imaging Alzheimer's disease: clinical applications.
Minoshima S.
Neuroimaging Clin N Am 2003; 13:769-780
参考資料6 Reference 6:
PET studies in dementia.
Herholz K.
Ann Nucl Med 2003; 17:79-89
参考資料7 Reference 7:
Functional neuroimaging in Alzheimer's type dementia.
Demetriades AK.
J Neurol Sci 2002; 203-204:247-251
キーワード:画像診断, ポジトロンエミッショントモグラフィー, 放射性医薬品, 18F-2-フルオロ-2-デオキシグルコース, ブドウ糖代謝, 脳血流SPECT, アルツハイマー病, 認知症, 痴呆, 軽度認知障害, 老人斑, 神経原繊維変化, β-アミロイド、タウ蛋白質, レビー小体型痴呆, 前頭側頭葉変性症, 血管性痴呆
diagnostic imaging, positron emission tomography, PET, radiopharmaceutical, 18F-2-fluoro-2-deoxyglucose, 18F-FDG, glucose metabolism, cerebral perfusion SPECT, 99mTc-HMPAO, 99mTc-ECD, 123I-IMP, Alzheimer's disease, dementia, mild cognitive impairment, MCI, senile plaque, neurofibrillary tangle, beta-amyloid, tau-protein, dementia with Lewy bodies, DLB, frontotemporal lobar degeneration, FTLD, frontotemporal dementia, FTD, vascular dementia, VaD
分類コード:030502, 030301, 030403




