| コンセプト |
画像化の様式 |
RI標識化合物の代表例 |
インビトロ
白血球標識 |
In vitroで白血球をRI標識し、それを体内に戻す |
1) 111In-オキシン(111In標識白血球)‐日米欧で臨床使用
2) 99mTc-HMPAO(99mTc標識白血球)‐欧米で臨床使用 |
イ
ン
ビ
ボ
白
血
球
標
識
|
白血球細胞膜の表面への結合 |
生体内にRI標識化合物を投与し、体内でRIを白血球に選択的に結合させる |
1) 99mTc-IgG
2) 99mTc-fMLP, 99mTc-LTB4 (chemotactic peptides)
3) 99mTc-IgM(NeutroSpec: anti-CD15 IgM)‐欧米で臨床使用
4) 膜表面抗原に特異的な様々なRI標識抗体
5) 膜受容体に特異的なRI標識化合物 |
| 白血球内への取込み |
白血球が盛んに取り込む物質をRI標識して体内に投与し、白血球に取り込ませる |
1) 99mTc-リポゾーム
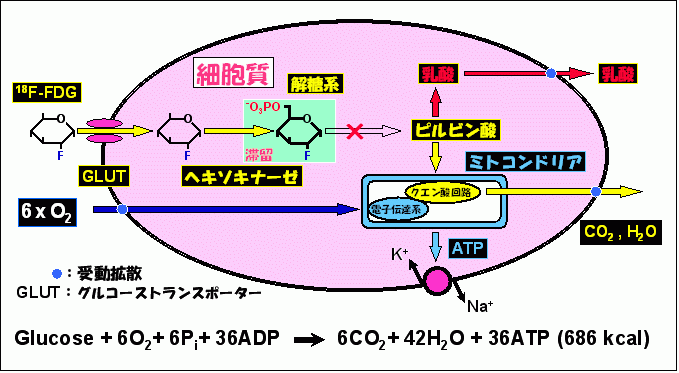
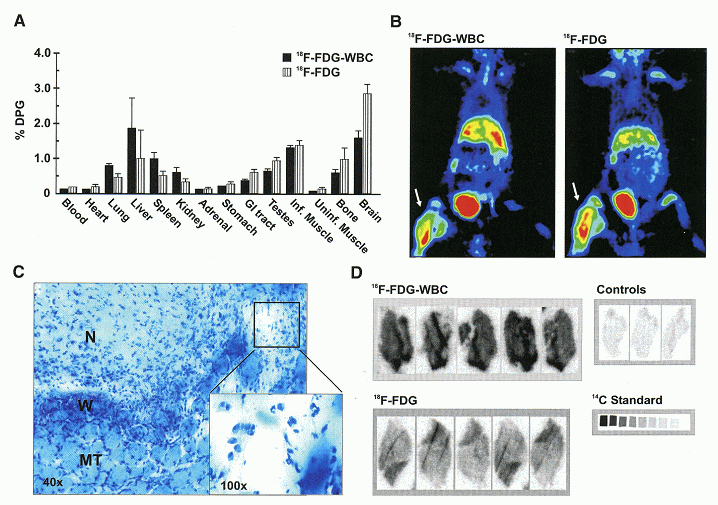
2) 18F-FDG‐日米欧で臨床使用
3) クエン酸ガリウム(67Ga)‐日米欧で臨床使用 |
| 病原体への結合 |
細菌に結合する化合物や抗生物質をRI標識し、生体内に投与する |
1) 99mTc-ciprofloxacin
2) 病原体に特異的な抗体
3) 99mTc-M13 phage(大腸菌に特異的なバクテリオファージ) |