放射線利用技術データベースのメインページへ
作成: 2006/1/3 鷲野 弘明
データ番号 :030272
FDG-PETによるがん骨転移の診断
目的 :FDG-PETによるがん骨転移診断の現状の紹介
放射線の種別 :陽電子
応用分野 :医学、診断
概要 :
がんの骨転移は、骨疼痛や病的骨折の原因となり患者QOLを低下させるため、症候性となる前に診断し適切に治療することが求められる。骨転移の検出に利用される様々な画像診断のひとつに核医学診断があり、99mTc-HMDPや99mTc-MDPによる骨シンチグラフィーが日常的に利用される。FDG-PETは、肺がん・乳がん・大腸がん等の悪性腫瘍の診断に使用されるが、骨転移もしばしば描出するため、FDG-PETによる骨転移診断の可能性について紹介する。
詳細説明 :
1. FDG−PETによるがん骨転移の診断
がんは、悪性化に伴ってしばしば骨に転移する。骨転移は、それ自体死因となることは少ないが、激しい骨疼痛・脊髄障害・病的骨折の原因となる。骨転移は、がん患者に大きな苦痛を与え、大幅な運動制限・長期臥床を余儀なくさせ、患者QOLの低下をもたらす。骨転移が症候性となる前に早期診断し適切に治療することは、患者QOL維持にとって重要な課題である。
近年、ビスホスホネート製剤(パミドロン酸、ゾレドロン酸等)のがん骨転移抑制効果が注目されている。ゾレドロン酸(ゾメタTM)は、がん患者において骨病変関連症状を減少させる効果があり、進行がんの骨病変に対する予防的治療の選択肢として重要性が高まった。このような治療薬を最大限に生かす患者管理には、治療すべき骨転移の早期鑑別診断が不可欠と思われる。
近年急速に普及しつつある18F-2-フルオロ-2-デオキシグルコース(18F-FDG)によるPETイメージング(以下FDG-PETと省略)は、がんの骨転移病巣を良く描出し、従来の骨シンチグラフィーとは質的に異なる情報を与える。FDG-PETの骨転移診断への応用は今後注目に値すると考えられ、ここにその現状を紹介する。
FDG-PET検査は、我国では2002年より、肺がん・乳がん・大腸がん・頭頸部がん・脳腫瘍・膵がん・悪性リンパ腫・転移性肝がん・悪性黒色腫・原発不明がんの診断で保険適用になった。特に、初発患者や治療後の再発患者におけるリンパ節・他臓器転移の検索に有用である。2005年より18F-FDG注射液が診断剤として市販され、PET装置を保有する病院ではFDG-PETは日常検査として実施されている。
18Fは、サイクロトロンで生産される物理的半減期110分の放射性核種であり、ポジトロン(β+)を放出する。β+は、反粒子で電子と一緒に消滅する際に510keVのγ線を2本反対方向に放射し、この2本のγ線放射を同時に捕らえて画像化するのがポジトロンエミッショントモグラフィー(PET)である。PETは、核医学画像診断装置の中では定量性や空間分解能に優れている。
2. がんの骨転移の病態
(1) 骨のリモデリング
骨は、石化した骨基質と内部の海綿質を満たす細胞成分(骨髄)からなる組織である。骨基質は、コラーゲンを主体とする有機質とそこに密に沈着したリン酸カルシウム微結晶(ヒドロキシアパタイト)で構成される。骨組織は、その形態を維持しながら常に新しい骨組織に置き換わるダイナミックな組織であり、成人では全骨格の3〜5%は常に置き換わっている(これを骨改造(リモデリング)という)(図1の模式図参照)。骨改造は、骨組織の溶解吸収と再形成のサイクルが繰り返されることで達成される。骨吸収(溶骨)は、大型の多核細胞である破骨細胞がリン酸カルシウムの溶解やコラーゲン分解により骨組織を吸収することをさす。破骨細胞が骨吸収を行うと、その部位では引き続いて骨芽細胞による骨形成(造骨)が起こる。
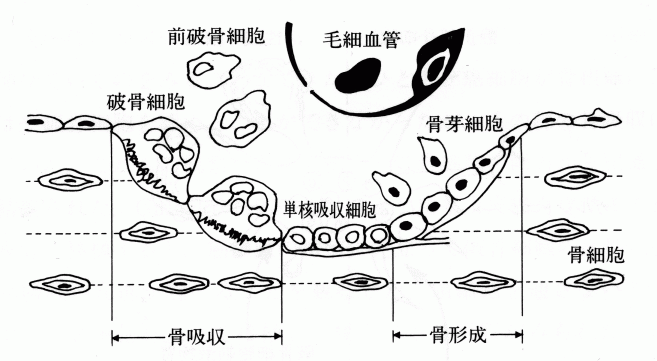
図1 骨リモデリングの模式図(原論文1より引用)
(2) がん細胞の骨転移
ある種のがんは、局所で発生し悪性化するとしばしば骨に転移する。骨転移の経路は、血行性転移・リンパ行性転移・直接浸潤・脊髄腔への播種の4経路がある。骨を原発としない悪性腫瘍では、一般的に血行性転移が多い。骨転移の発生頻度が高い主ながんは、前立腺がん・乳がん・肺がん・腎がん・膀胱がん・甲状腺がん・胃がんであり、成人男性では前立腺がんが、成人女性では乳がんが、最も高頻度に骨転移をきたす。小児では、神経芽腫・Ewing腫・骨肉腫で骨転移の頻度が高い。骨転移が発見されやすい部位は、血流豊富な赤色髄の多い躯幹骨で、脊柱・骨盤骨・肋骨・胸骨・大腿骨・上腕骨・頭蓋骨である。脊柱では、腰椎・胸椎・頚椎の順に骨転移の頻度が高い。
がん細胞が骨に生着しそこで骨転移を形成するには、複数のステップが必要となる。まず、原発巣を離れたがん細胞は、血行性に移動し、血流が豊富で停滞しやすい赤色髄に辿り着く。骨髄間質細胞は、接着分子VCAM-1(vascular cell adhesion molecule-1)を発現しているため、そのリガンドであるVLA-4を発現するがん細胞は、特に骨髄に残留しやすい。がん細胞は、栄養血管を形成しつつ海綿質内の骨梁間に増殖し、ここに骨転移の初期像が成立する。骨転移しやすいがん細胞の多くは、様々な骨吸収性サイトカイン(OAF)やPTH関連蛋白質(PTHrP)を産生し、破骨細胞による骨吸収を亢進させる。一方、骨組織はIGF-1・TGF-β・FGF・PDGF等の増殖性サイトカインを産生〜蓄積しており、骨吸収に伴ってこれらサイトカインが放出されると、その受容体を発現したがん細胞にとって増殖しやすい環境が成立する。
がん細胞は、到達した骨組織に生着し、骨吸収を亢進させて細胞増殖が可能な空間的余地を作り出し、細胞増殖を促すサイトカインに応答して増殖する。骨転移とはがん細胞と骨組織の相互作用の結果成立するものであり、これは他臓器における転移では見られない特徴といえる。
(3) 骨転移の分類
骨転移局所における骨の反応は、がんの種類によって異なる。恐らくは、局所でどのサイトカインの機能が優勢かで決まるものと推測される。骨転移の特徴は、X線所見より造骨型か溶骨型に分けられるが、病理学的には転移骨の反応を見ない骨梁間型、これらが共存する混合型の4基本型に分類される。これらの基本型は、転移に伴う骨組織の反応、即ちがん細胞と骨の相互作用の特徴を分類したものである。
造骨型:骨形成が優勢。転移に伴って新しい骨が正常な骨の表面に積み重なるように形成され、骨梁の破壊は見られない。
溶骨型:骨吸収が優勢。骨基質の溶解及び骨梁の破壊・収縮が見られる。
骨梁間型:造骨性あるいは溶骨性の反応は見られない。骨梁の変化を伴わずに、骨内部の海面質内や洞内にがん細胞の浸潤転移が見られる。骨転移の初期像と推測される微小転移、全身骨格に広範に転移するが局所反応を伴わない骨転移も、この骨梁間型に分類し得る。
混合型:同一転移巣内に造骨性及び溶骨性の骨反応が共存する。

図2 骨転移の分類と病理組織学的特徴
a:乳がんの椎骨転移(造骨型):写真内の左は摘出組織、中央の白黒写真はその骨組織標本、右は染色組織標本である。左側で椎骨内部の淡黄色部分が骨転移領域であり、これは骨組織標本で白色部分に一致する。この部分は明瞭な造骨を認める。
b:乳がんの椎骨転移(溶骨型):写真内の左は摘出組織(左上段は正常な椎骨、中段及び下段は黒く壊死した骨転移巣を含む椎骨)、右の白黒写真はその骨組織標本である。黒く壊死した骨転移領域に相当する部分は、右の骨組織標本では脱灰し、骨組織の構造が破壊されているのが分かる。
c:乳がんの椎骨転移(骨梁間型):写真内の左は骨組織標本、右は染色組織標本である。左の骨標本から分かるとおり、骨梁間型では転移骨の反応は見られないが、がん細胞は骨梁間に広く浸潤している。(原論文2より引用)
4つの基本型は各々独立したものではなく密接に関連しあい、転移骨の反応としては両極端に位置する造骨型と溶骨型であっても相互に移行し得る。がんの種類と骨転移の型には一定の傾向が見られる。例えば、甲状腺がん・腎がん・骨髄腫では溶骨型、前立腺がんでは造骨型、肺小細胞がんでは骨梁間型が多く、乳がん・肺腺がん・胃がんでは様々な型が共存することが多い(図3参照)。

図3 がんの原発臓器・組織型と転移骨の反応(原論文3より引用)
3. がん骨転移の画像診断
(1) 骨転移の画像診断の選択肢
がんの治療戦略は、がんの初発部位及び全身における拡がりの程度(=『病期』として定義される)よって大きく異なる。ゆえに、病期診断では、骨転移の有無やその部位を確認することは治療方針決定上重要なポイントとなる。
骨転移の検索は、臨床症状・単純X線撮影・CT・MRI・核医学・血液検査(Ca濃度・血清ALP等)・尿検査等を、患者の状態とがんの種類に応じて適宜組み合わせ実施する。骨転移は、X線写真やCT像では、局所の骨吸収あるいは骨形成を反映した異常な陰影、骨梁構造の破壊像より診断される。MRIでは、骨転移部位のコントラスト変化や骨破壊像より診断される。近年普及した拡散強調撮像法(DWI)によるMRIも、骨転移検出に優れた方法として認識されつつある。核医学診断の場合、骨シンチグラフィー(99mTc-HMDPや99mTc-MDP)、FDG-PET、18F-NaF-PETが骨転移の診断に利用可能である。18F-NaF-PETは、我国の日常診療では利用されていないが99mTc-HMDPや99mTc-MDPと似た骨集積機序により骨転移を診断する。
骨転移検索で汎用される単純X線撮影は、造骨型・溶骨型・混合型骨転移の80〜90%を検出しうるが、骨転移の初期像で最も高頻度に見られるはずの骨梁間型はほとんど検出できない。骨シンチグラフィーでもこうした骨梁間型の小さな骨転移巣の検出〜同定は困難である。骨梁間型の頻度が高い肺小細胞がん・肝細胞がん・胃がん・膵がんでは、様々な画像診断法を適切に組み合わせて診断することが必要である。
(2) 99mTc-HMDPや99mTc-MDPとFDG-PETの骨転移集積機序の違い
99mTc-HMDP・99mTc-MDPは、99mTcとビスホスホネートの錯体を基本骨格とし、ビスホスホネート部分はカルシウムに親和性を持つ。99mTc-ビスホスホネートは、血流にのって骨組織に到達するとヒドロキシアパタイトに結合する。骨形成後間もない新生骨表面はヒドロキシアパタイト結晶が微細であり、ビスホスホネートを吸着し得る骨表面積は成熟骨のそれに比べて著しく大きい。99mTc-HMDPや99mTc-MDPは、骨形成が亢進した造骨型骨転移に優先的に集積する傾向が強い。これが骨シンチグラフィーの診断メカニズムである。
一方、18F-FDGは、細胞のブドウ糖代謝活性を反映して細胞内に取り込まれる特性を有し、骨転移を形成するがん細胞そのものに集積すると推測される。ゆえに、18F-FDGの場合は、造骨型あるいは溶骨型といった転移骨の反応に応じた集積を示すというより、骨転移を形成するがん細胞それ自体の代謝活性あるいは悪性度に応じて集積すると考えられる。
核医学診断では、異なった診断剤が同一検査目的で使用されても、各診断剤固有の集積機序に応じて本質的に異なった情報を提示する。ゆえに、診断剤の集積機序を理解することは読影上重要である。例えば、99mTc-HMDPや99mTc-MDPは、骨形成が亢進する病態であれば同様に集積するため、脊椎圧迫骨折・感染性脊椎炎・脊椎血管腫・骨壊死・肥厚性骨関節症・PTHrPによる骨吸収でも集積する。高齢者ではこのような疾患がしばしば見られる。一方、18F-FDGは、ブドウ糖代謝が盛んな炎症性細胞(例えば白血球やマクロファージ)があればそこに集積するため、骨髄炎など様々な炎症性骨疾患は偽陽性となる。
5. 18F-FDGと99mTc-MDPの骨転移診断性能の比較:乳がんと前立腺がんの例
男女で最も高頻度に骨転移が見られる乳がんと前立腺がんについて、骨シンチグラフィーとFDG-PETの骨転移診断性能の違いを紹介する。
(1) 乳がん
様々な骨転移型が共存し得る乳がん患者では、一般的には骨シンチグラフィーの診断性能はFDG-PETより高いと言われる。しかし、99mTc-HMDP・99mTc-MDPとFDG-PETの比較研究に関する文献報告は、やや混乱した印象を与える。例えば、
●Ohtaらは、通常の骨転移検索で9人に骨転移が判明した51人の乳癌患者について99mTc-MDPとFDG-PETの診断性能を比較した。その結果、感度:両診断剤とも77.7%、特異度:FDG-PET(97.6%)>99mTc-MDP(80.9%)、であった。
●Gallowitschらは、38人の乳癌患者の骨転移について骨転移部位別に99mTc-MDPとFDG-PETの診断性能を比較した。その結果、感度:99mTc-MDP(89.8 %)>FDG-PET(56.5%)、特異度:FDG-PET(88.9%)>99mTc-MDP(74.1%)、であった。
●Nakaiらは、89人の乳がん患者について骨転移の型別に99mTc-HMDPとFDG-PETの診断性能を比較した。全ての部位を総合した「感度/特異度/正診率」は、99mTc-HMDPでは「78.2%/82.4%/79.8%」、FDG-PETでは「80.0%/88.2%/83.1%」となり、両剤に差はなかった。しかし、CTで判断した骨転移型別の検出率を見ると、造骨型:99mTc-HMDP(100%)>FDG(55.6%)、溶骨型:FDG(100%)>99mTc-HMDP(70.0%)、混合型:FDG(94.7%)>99mTc-HMDP(84.2%)、Invisible on CT:FDG(87.5%)>99mTc-HMDP(25.0%)であった。
●Lonneuxらは、39人の外科手術を受けた乳がん患者について99mTc-MDPとFDG-PETの診断性能を比較した。通常の骨転移検索では、39人中33人で次の39転移が確認された 〜 骨又は骨髄:10、肝:6、リンパ節:16、その他:7。39人の読影で検出できた割合を見ると、99mTc-MDP:6人、FDG-PET:31人。FDG-PETの検出率は99mTc-MDPより良かった。なお、39人の多くはすでに化学療法や放射線治療を受けていた。
様々な報告が錯綜するため判断しにくいが、骨転移型別に両剤の診断性能を比較すると、溶骨型・混合型骨転移ではFDG-PET>99mTc-MDP、造骨型骨転移では99mTc-MDP>FDG-PETとするのが妥当と思われる(Cookらによる)。溶骨型骨転移のある乳がん患者の生命予後は、造骨型・混合型骨転移のある患者の予後より短かい、との興味深い報告もある。溶骨型骨転移は99mTc-MDPよりFDG-PETで陽性となりやすく、そのような乳がんは悪性度が高いと言えるかもしれない。
以下に、99mTc-MDPとFDG-PETの乳がん骨転移のイメージを示す。
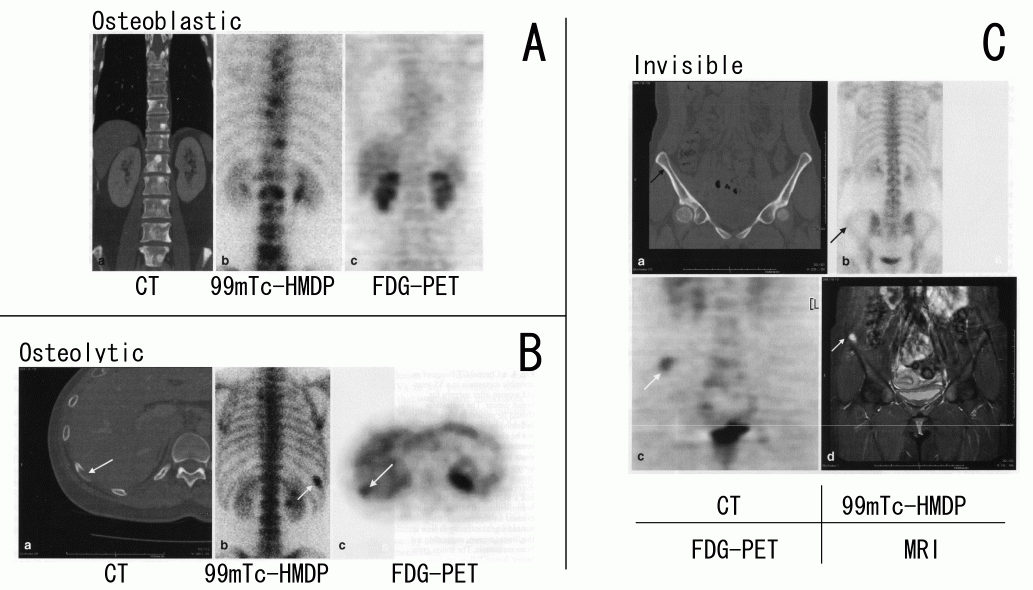
図4 乳がんに患者における99mTc-HMDPとFDG-PETの骨転移イメージの比較例
A:造骨型骨転移:CTでは脊柱に多数の繊維化した骨転移巣(白い点)を認め、その部分に一致して99mTc-HMDPの集積を認める。しかし、FDGは集積していない。FDG-PETが偽陰性となった例である。
B:溶骨型骨転移:CTでは右第10肋骨に骨転移巣を認め、その部分に一致して99mTc-HMDPとFDGの集積を認めた。
C:CT像で確認できない骨転移(恐らくは骨梁間型):骨転移は腸骨に存在するが(CTで矢印部分)、CTでは指摘困難である。99mTc-HMDPの集積も認めず、FDG-PETの陽性像として存在が示唆された。脂肪抑制Gd造影MRIでは、FDG-PETで集積のあった位置に一致して病変が認められた。(原論文4より引用)
(2) 前立腺がん
造骨型骨転移が多い前立腺がんでは、文献報告は99mTc-MDPの骨転移検出感度がFDG-PETより明らかに高いという結果で一致している。即ち、FDG-PETは偽陰性率が高いため、前立腺がんの骨転移検索には向いていないといえる。
こうした中で、Morrisらの注意深い比較臨床研究は興味深い。彼らは、進行期にある17人の前立腺がん患者をPSA値の上昇幅(50%以上)で注意深く選択し、6週間の間隔をおいて99mTc-MDPとFDG-PETをそれぞれ2回スキャンし、99mTc-MDPとFDG-PETで検出された合計134の骨転移巣について2回のスキャン結果を病巣ごとに比較した。その結果、99mTc-MDPまたはFDG-PETで検出できた全 134病巣のうち両剤共に検出したのは95病巣、99mTc-MDPだけが検出したのは31病巣、FDG-PETだけが検出したのは8病巣であった。検出感度で言えば、明らかに99mTc-MDP(94%)>FDG-PET(77%)となる。しかし、99mTc-MDPだけが描出した31の骨転移巣は、PSA値が上昇したにもかかわらず6週間のあいだ変化しなかった。一方、FDG-PETが描出した全骨転移巣はすべて増大していた。FDG-PET陽性の前立腺骨転移は、明らかに活動性が高いことを示唆する。
患者QOL維持のためには骨転移の早期診断治療が大切との観点からすれば、FDG-PET陽性のactiveな骨転移の治療的意義は、決してFDG-PET陰性/99mTc-MDP陽性のsilentな骨転移のそれとは同じではない。FDG-PETの情報量を示唆する報告である。
コメント :
核医学診断により骨転移の活動度が評価可能なら、患者の状態に応じた治療の個別化に道を開く可能性がある。
原論文1 Data source 1:
骨転移の痛みと治療
檀 健二郎
真興交易医書出版部 1990
原論文2 Data source 2:
骨転移の病態と病理
高嶋 成光
乳がんの臨床 1998; 13:247-252, 篠原出版新社
原論文3 Data source 3:
骨転移の病理
森脇 昭介
骨転移−病態・診断・治療、大森 弘之 監修、金芳堂 1995
原論文4 Data source 4:
Pitfalls of FDG-PET for the diagnosis of osteoblastic bone metastases in patients with breast
cancer.
Nakai T, Okuyama C, Kubota T et al.
Eur J Nucl Med Mol Imaging 2005: 32(11);1253-1258.
参考資料1 Reference 1:
Positron emission tomography and bone metastasis
Fogelman I, Cook G, Israel O et al
Semin Nucl Med 2005: 35;135-142.
参考資料2 Reference 2:
特集 転移の画像診断−骨
辰野 聡, 清水 桜, 青柳 裕, 萩 成行
癌の臨床 2005; 51:905-914
参考資料3 Reference 3:
Whole body PET for the evaluation of bony metastases in patients with breast cancer: Comparison with 99mTc-MDP bone scintigraphy.
Ohta M, Tokuda Y, Suzuki Y et al.
Nucl Med Commun 2001: 22;875-879.
参考資料4 Reference 4:
F-18 fluorodeoxyglucose positron-emission tomography in the diagnosis of tumor recurrence and metastases in the follow-up of patients with breast carcinoma.
Gallowitsch HJ, Kresnik E, Gasser J et al.
Invest Radiol 2003: 38;250-256.
参考資料5 Reference 5:
The place of whole-body FDG PET for the diagnosis of distant recurrence of breast cancer.
Lonneux M, Borbath H, Berliere M et al.
Clin Positron Imaging 2000: 3;45-49.
参考資料6 Reference 6:
Detection of bone metastases in breast cancer by 18FDG PET: differing metabolic activity in osteoblastic and osteolytic lesions.
Cook GJ, Houston S, Rubens R et al.
J Clin Oncol 1998: 16;3375-3379.
参考資料7 Reference 7:
Fluorinated deoxyglucose positron emission tomography imaging in progressive metastatic prostate cancer.
Morris MJ, Akhurst T, Osman I et al.
Urology 2002: 59;913-918.
キーワード:画像診断, ポジトロンエミッショントモグラフィー, 骨シンチグラフィー, 放射性医薬品, 18F-2-フルオロ-2-デオキシグルコース, ブドウ糖代謝, 骨転移, 破骨細胞, 骨吸収, 骨芽細胞, 骨形成, 骨リモデリング, 腫瘍, 乳がん, 前立腺がん
diagnostic imaging, positron emission tomography, PET, bone scintigraphy, radiopharmaceutical, 18F-2-fluoro-2-deoxyglucose, 18F-FDG, 99mTc-HMDP, 99mTc-MDP, glucose metabolism, bone metastasis, osteoclast, osteolysis, osteoblast, osteogenesis, bone remodeling, tumor, breast cancer, prostate cancer
分類コード:030502, 030301, 030403
放射線利用技術データベースのメインページへ


