作成: 2005.1.2 鷲野 弘明
データ番号 :030270
PET用心筋血流診断剤:13N-アンモニア
目的 :PET用心筋血流診断剤13N-アンモニアの特徴の説明
放射線の種別 :陽電子
応用分野 :医学、診断
概要 :
13N-アンモニア(13N-NH3)は、静脈内に投与されると毛細血管から抹消組織に拡散移行し、心臓の心筋細胞に良く取り込まれる。心筋細胞内では、13N-NH3はグルタミン合成酵素によってグルタミン酸と結合してグルタミン分子中に取り込まれ、細胞内に長くとどまる。13N-NH3は、このメカニズムと血液からの速い消失ゆえに、優れた画質の心筋血流イメージを与える。13N-NH3の初回心筋抽出率は90%程度、心筋血流量との相関性も良好で、13N-NH3/PETは心筋血流評価に優れた検査である。ただ、13Nの物理的半減期が10分と短いため、日常検査として実施するには難しい一面を有する。
詳細説明 :
1. 研究開発の歴史
核医学における心筋血流検査は、心筋梗塞等の冠動脈疾患の診断を目的として、1970年代に201TlClで始まり、1980年代以降99mTc標識化合物の出現によって一気に普及した。ただし、201Tlや99mTcといったSPECT核種による心筋イメージングでは、生体によるγ線の散乱や吸収・低い空間分解能といった技術的問題により、局所心筋血流を高精度で定量的に測定することは難しい。1970年代後半に実用化されたPET(positron emission computed tomography)は、SPECT(single photon emission computed tomography)が抱えるこうした技術的限界を解決しうる性能を持つ技術であり、PET装置が開発されるとPETを心筋血流イメージングに応用する研究が直ちに始まった。
PET核種N-13で標識された13N-アンモニア(13N-NH3)による心筋血流イメージングの可能性は、すでに1970年代前半より本格的に研究されており、PETが実用化された1970年代後半より13N-NH3/PETの研究成果が散見され始める。13N- NH3は、静脈内投与後直ちに心筋組織に取り込まれ、代謝を受け心筋細胞内にとどまる。13N-NH3は局所心筋血流の評価、すなわち心筋梗塞診断に適しており、多くの臨床研究が行われることとなった。
N-13は、一般に16O(p,α)13N反応によりサイクロトロンで生産される物理的半減期10分の放射性核種であり、ポジトロン(β+:陽電子)を放出する。ポジトロンは、反粒子で生成後短時間で電子とともに消滅する際に510keVのγ線を2本反対方向に放射する。この2本のγ線放射を同時に捕らえて画像化する装置がPETであり、核医学画像診断装置の中では定量性や空間分解能に優れる。
現在、13N-NH3は我国では医薬品としては認可されていない。
2. 13N-アンモニアの細胞内集積機序
13N-NH3は、静脈内に投与されると毛細血管から抹消組織に速やかに拡散移行し、細胞内に直ちに取り込まれる。この過程は、以下のように考えられている。13N-NH3の血液、間質液中における存在形は、それと平衡関係(NH3+H+⇔NH4+)にあるアンモニウムイオン(13N-NH4+)であるが、水溶性のNH4+は脂溶性のNH3に比べて細胞膜透過性が著しく低い。それゆえ、細胞膜を受動拡散により透過し細胞内に移行するのはNH4+ではなくNH3と一般的に考えられている。
細胞はブドウ糖を消費しATPを生産する過程でCO2を発生させるため、細胞内pHは一般的に細胞外pHより0.2〜0.5ほど低い。投与された13N-NH3が細胞内外で濃度平衡に達したとき、この細胞内外のpH勾配より細胞内濃度は細胞外より高くなる(理論的には1.6〜3.2倍高濃度になると計算される)。細胞内外のこの濃度差は、NH3の速い細胞膜透過、速いprotonation(NH3+H+⇔NH4+)、pH差による細胞内NH4+濃度割合の増大、という三要素の結果として生じるが、pH勾配の存在が必須である。
こうして細胞内に入ってきた13N-NH3が今度は細胞内の代謝系によって消費されることで、細胞内外の"13N"濃度差はさらに増幅される。細胞内では、13N-NH3はグルタミン合成酵素の働きによりグルタミン酸と結合し、グルタミン分子中に取り込まれる。その結果、13Nは細胞内に一時的に固定され細胞外への流出が止まり、最終的に細胞内外で大きな濃度差が生まれる(これをmetabolic trappingといい、イメージコントラストを生むメカニズムの本質である)。Metabolic trapping機構は、グルタミン合成酵素阻害剤である1-methionine sulfoximineがin vitro/in vivoにおいて13N-NH3の細胞内滞留を減少させることからも支持されている。metabolic trappingの経路を模式的に図1に示した。
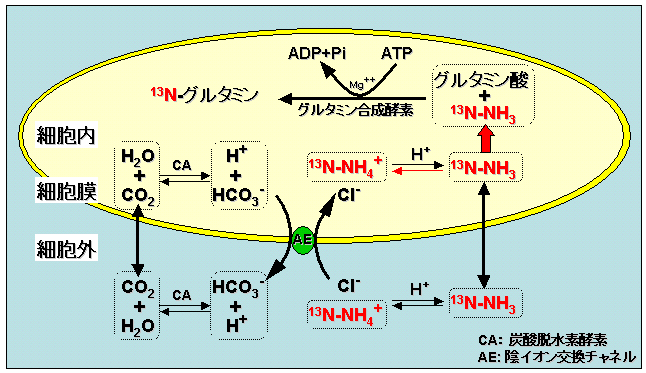
図1 13N-アンモニアの細胞内集積機序(原論文1の図をもとに一部改変。
Reprinted by permission of American Heart Association from:
Rauch B, Helus F, Grunze M, Braunwell E, Mall G, Hasselbach W, Kuebler W. Kinetics of 13N-ammonia uptake in myocardial single cells indicating potential limitations in its applicability as a marker of myocardial blood flow. Circulation 1985; 71:387-393. Figure 7)
細胞膜内外のpH勾配は、細胞膜内外の電位差と同様に細胞が生きているがゆえの現象であり、グルタミン合成系への取り込みも同様である。13N-NH3による心筋イメージングが、心筋の生死やバイアビリティの評価に結びつく所以である。
3. 13N-アンモニアの心筋集積kinetics
13N-NH3は、静脈内投与後心筋細胞に直ちに取り込まれる。13N-NH3の初回循環における心筋抽出率(first-pass extraction fraction)は約90%であり、201TlClや99mTc-MIBIより優れる。細胞内では13N-NH3は直ちに13N-グルタミンに代謝されるが、細胞内グルタミンプールの容量は大きくそのturnoverも遅いため、"13N"としての細胞内滞留半減期は長い。一方、13N-NH3の血中消失速度は極めて速いため、投与早期より高い心臓/血液比を達成でき、優れた画質の心筋イメージが得られる。
心筋イメージより局所心筋血流量を定量するときには、画像上の関心領域における時間-放射能曲線を求め、それを2コンパートメントあるいは3コンパートメントモデルで解析する。図2に動物実験用の3コンパートメント解析モデルの例を示す。
実際の計算では、これにN-13物理的減衰の補正や後述する代謝産物による影響の補正などを加えるので、かなり複雑な処理となる。
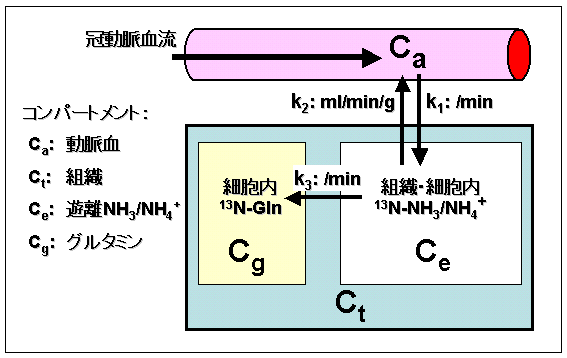
図2 13N-アンモニアの3コンパートメント動力学解析モデル(原論文2の図をもとに一部改変。
Reprinted by permission of the Society of Nuclear Medicine from:
Muzik O, Beanlands RSB, Hutchins GD, Mangner TJ, Nguyen N, Schwaiger M. Validation of nitrogen-13-ammonia tracer kinetic model for quantification of myocardial blood flow using PET. J Nucl Med 1993; 34:83-91. Figure 2)
13N-NH3のコンパートメント解析における問題点のひとつは、静脈内投与後速やかに代謝を受け、代謝産物が血液中に出現する点である。Rosenspireらによれは、ヒト血液中におけるその代謝産物の割合は以下のようである。13N-NH3の心臓への集積から局所心筋血流量を定量するときには、血中代謝産物を考慮してinput functionを補正する。
表1 ヒト血液中の13N-NH3代謝産物(原論文4より引用)
| |
標識体の存在割合 (%) /投与後時間 (分) |
| 13N-標識体 |
1分 |
2分 |
3分 |
4分 |
5分 |
| アンモニア |
93.1 |
94.0 |
81.8 |
74.7 |
50.2 |
| 尿素 |
3.1 |
1.5 |
7.2 |
11.1 |
32.7 |
| 中性アミノ酸 |
3.0 |
4.0 |
10.4 |
13.8 |
16.2 |
| 酸性アミノ酸 |
0.8 |
0.4 |
1.1 |
0.4 |
0.9 |
13N-NH3が心冠動脈疾患の診断剤として有効であるためには、局所心筋血流量と放射能集積間に高い相関性が求められる。図3にイヌにおける3コンパートメント解析で得られた局所心筋血流量とradiolabeled microsphere法で得られた血流量の比較結果を示す。なお、radiolabeled microsphere法による心筋血流測定は、動物実験レベルではしばしば標準測定法として利用されるが、臨床的には利用されない。
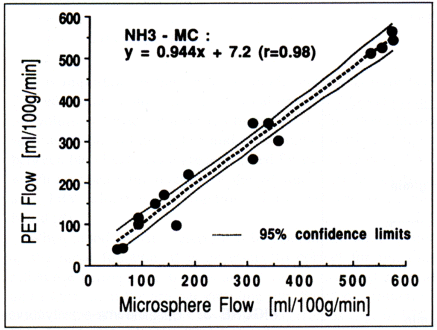
図3 13N-NH3/PETにより得られた局所心筋血流量とradiolabeled microsphere法により得られた局所心筋血流量の比較
イヌによる実験結果で、13N-NH3/PETでは、血中代謝産物による影響を補正したinput functionを用いて計算した。
(原論文2より引用。 Reprinted by permission of the Society of Nuclear Medicine from:
Muzik O, Beanlands RSB, Hutchins GD, Mangner TJ, Nguyen N, Schwaiger M. Validation of nitrogen-13-ammonia tracer kinetic model for quantification of myocardial blood flow using PET. J Nucl Med 1993; 34:83-91. Figure 5)
13N-NH3/PETより得られた血流量は、microsphere法による測定結果と比較して高血流量領域まで良好な相関関係にある。以上より、13N-NH3/PETでは、放射能の心筋への取り込みは局所心筋血流量に比例しており、コンパートメントモデル解析を行えば、正確な局所心筋血流量の算出が可能である。大動物やヒトでは、13N-NH3/PETは冠動脈の状態・心筋への血液灌流状態・冠動脈予備能の診断や経過観察に適した検査といえる。
4. 13N-アンモニア注射液の組成及び用法・用量
13N-NH3注射液は医薬品として認可されていないため、医薬品に準じた組成表示はできない。13N-NH3注射液によるPET検査実施機関の論文報告を見ると、13Nは病院内のサイクロトロンで生産され、13N-NH3注射液はそこから無菌的に調製されている。多くは、生理食塩液に溶解される。
13N-NH3注射液は、通常静脈内に投与され、投与直後よりPET装置にて撮像する。投与量や投与回数は、対象疾患・検査目的・患者の体重などにより適宜増減するが、論文報告例を見ると370〜555MBqが一般的である。
13N-NH3/PET検査は、安静時と冠動脈拡張負荷時の2回計測からなるのが一般的である。冠拡張負荷は、static収集の場合は運動負荷または薬剤負荷のいずれも利用できるが、注射剤静注後連続してdynamic収集を行い心筋血流量の定量を行う場合は薬剤負荷を用いる。2回目の計測は、N-13の物理的半減期が10分であることから、5半減期以上の時間間隔(約1時間)をおいて行うのが一般的である。
5. 13N-アンモニア注射液の臨床的有用性
13N-NH3注射液は医薬品として認可されていないため、医薬品に準じた効能又は効果として示すことはできない。論文報告を見ると狭心症・心筋梗塞における血流状態の評価、冠動脈再開通後の血流状態の評価、心筋バイアビリティの評価などに有用と考えられる。
6. 13N-アンモニア注射液の臨床適用
心筋梗塞患者における臨床応用例を図4に示す。
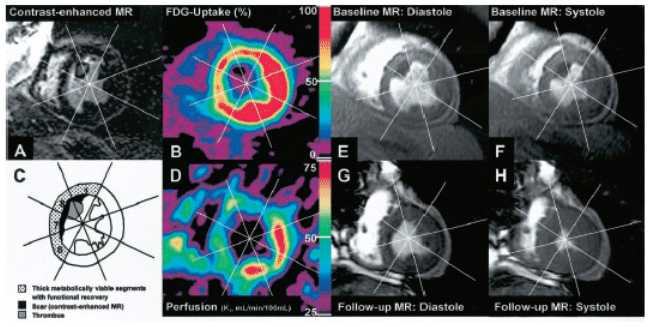
図4 59歳の心筋梗塞患者における13N-NH3/PET検査の例
A:造影MR像(心患部の冠状断面像)、B:18F-FDG/PET、C:心患部の冠状断面の模式図、D:13N-NH3/PET、E:心拡張期のMRI像、F:心収縮期のMR像、G:心拡張期のMRI像、H:心収縮期のMR像
撮像時期:A〜F/発症後5ヶ月時点で冠動脈バイパス移植術直前、G〜H/冠動脈バイパス移植術後9ヶ月時点
(原論文3より引用。 Reprinted by permission of American Heart Association from:
Knuesel PR, Nanz D, Wyss C, Buechi M, Kaufman PA, von Schultheiss GK, Luescher TF, Schwitter J. Characterization of Dysfunctional myocardium by positron emission tomography and magnetic resonance: Relation to functional outcome after revascularization. Circulation 2003; 108:1095-1100. Figure 5)
この患者は心筋梗塞を発症し、5ヵ月後に冠動脈バイパス移植術を受けることとなった。A:造影MRI像は、左心室内腔の大きな血栓(segment 8)とそれに接する心室中隔内膜下に瘢痕(白い領域)の存在を示している。B:18F-FDG/PETは、集積程度は低いものの中隔領域にもFDGの取り込みがあり、この部分の心筋が生存していることを示す。しかし、D:13N-NH3/PETは中隔領域の血流が大きく低下し、E:心拡張期のMRI像とF:心収縮期のMR像の比較から、中隔領域の心機能が大きく低下していることがわかる。Segment 1,6,7,8の領域が心筋梗塞となっている。この患者に冠動脈バイパス移植術を施行して梗塞領域の冠動脈再開通をはかり、その9ヶ月後に撮像したMRI像がG及びHである。この患者は、再開通によって心機能を回復させることができた。
7. 13N-アンモニア注射液の副作用
13N-NH3注射液中のアンモニア量は極微量であり、文献報告を見る限り特に問題となるような副作用の記載はない。
コメント :
N-13の物理的半減期が10分しかないという点があらゆる意味で普及を妨げる結果となっている。まず、そのような超短半減期では商業生産には向かない。また、日常検査として実施するには、病院内サイクロトロンでN-13を製造し直ちに製剤化して患者に投与するという一連の手順が確立していなければならない。これを日常的に実施するには負荷が大きく、現時点では201TlClや99mTc-MIBIによるSPECT検査が日常診療に根付いている。
原論文1 Data source 1:
Kinetics of 13N-ammonia uptake in myocardial single cells indicating potential limitations in its applicability as a marker of myocardial blood flow.
Rauch B, Helus F, Grunze M, Braunwell E, Mall G, Hasselbach W, Kuebler W.
Universitaet Heidelberg, Dept Innere Medizin III(Kardiologie).
Circulation 1985; 71:387-393.
原論文2 Data source 2:
Validation of nitrogen-13-ammonia tracer kinetic model for quantification of myocardial blood flow using PET.
Muzik O, Beanlands RSB, Hutchins GD, Mangner TJ, Nguyen N, Schwaiger M.
Div of Nuclear Medicine, Dept of Internal Medicine, Univ Michigan Medical Center.
J Nucl Med 1993; 34:83-91.
原論文3 Data source 3:
Characterization of Dysfunctional myocardium by positron emission tomography and magnetic resonance: Relation to functional outcome after revascularization.
Knuesel PR, Nanz D, Wyss C, Buechi M, Kaufman PA, von Schultheiss GK, Luescher TF, Schwitter J.
Div of Cardiology, Clinic of Nuclear Medicine and Institute of Diagnostic Radiology, University Hospital Zurich.
Circulation 2003; 108:1095-1100.
原論文4 Data source 4:
Metabolic fate of [13N] ammonia in human and canine blood.
Rosenspire KC, Schwaiger M, Mangner TJ, Hutchins GD, Sutorik A, Kuhl DE.
Div of Nuclear Medicine, Dept of Internal Medicine, Univ Michigan Medical Center.
J Nucl Med 1990; 31:163-167
参考資料1 Reference 1:
Clinical feasibility of myocardial imaging with 13NH3.
Harper PV, Lasthrop KA, Krizek H, Lembares N, Stark V, Hoffer PB.
J Nucl Med 1972; 13:278-280.
参考資料2 Reference 2:
Tomographic images of blood pool and perfusion in brain and heart.
Phelps ME, Hoffman EJ, Coleman RE, Welch MJ, Raichle ME, Weiss ES, Sobel BE, Ter-Pogossian MM.
J Nucl Med 1976; 17:603-612.
参考資料3 Reference 3:
Regional myocardial perfusion assessed with N-13 labeled ammonia and positron emission computerized axial tomography.
Schelbert HR, Phelps ME, Hoffman EJ, Huang SC, Sellin CE, Kuhl DE.
Div of Nuclear Medicine, Dept of Internal Medicine, Univ Michigan Medical Center.
Am J Cardiol 1979; 43:209-218.
参考資料4 Reference 4:
Kinetics of 13N-ammonia uptake in myocardial single cells indicating potential limitations in its applicability as a marker of myocardial blood flow.
Rauch B, Helus F, Grunze M, Braunwell E, Mall G, Hasselbach W, Kuebler W.
Universitaet Heidelberg, Dept Innere Medizin III(Kardiologie).
Circulation 1985; 71:387-393.
参考資料5 Reference 5:
N-13 ammonia as an indicator of myocardial blood flow: Factors influencing its uptake and retention in myocardium.
Schelbert HR, Phelps ME, Huang SC, Welch M, Sobel BE.
Div of Nuclear Medicine, Dept of Internal Medicine, Univ Michigan Medical Center.
Circulation 1981; 63:1259-1272.
参考資料6 Reference 6:
クリニカルPET −臨床応用のためのガイドブック−
監修 鳥塚 莞爾
先端医療技術研究所、1997.3.25発行
キーワード:画像診断, ポジトロンエミッショントモグラフィー, 放射性医薬品, 13N-アンモニア, 心筋血流, 心筋バイアビリティ, 冠動脈予備能, 心筋梗塞, 心筋虚血, 狭心症,
diagnostic imaging, positron emission computed tomography, PET, radiopharmaceutical, 13N-Ammonia, myocardial blood flow, myocardial viability, coronary functional reserve, myocardial infarction, myocardial ischemia, angina pectoris, 201TlCl, 99mTc-MIBI
分類コード:030502, 030301, 030403



