放射線利用技術データベースのメインページへ
作成: 2003/12/30 鷲野 弘明
データ番号 :030258
PET用腫瘍診断剤:F-18-フルオロアミノ酸
目的 :18F-フルオロアミノ酸に関する研究動向の紹介
放射線の種別 :陽電子
応用分野 :医学、診断
概要 :
様々な化学構造の11C/18F標識アミノ酸誘導体が30年来研究されてきたが、近年PET装置の普及に伴って再び注目を集めている。特に18F標識アミノ酸は、18F-FDGの欠点を補う次世代のPET用診断剤として、CT・MRIや18F-FDG/PETでは診断困難な腫瘍等への適用が研究されている。多くの18F-フルオロアミノ酸は、天然アミノ酸ではないため蛋白質に取り込まれないが、アミノ酸代謝速度に応じて細胞内に集積すると考えられる。11C標識誘導体は、11Cの超短半減期ゆえに商業化は困難だが、18F標識体は可能であり、今後の進展が期待される。
詳細説明 :
腫瘍の画像診断は、通常CTやMRIで行われる。しかし、良性/悪性の鑑別・手術後再発の診断・他病変との鑑別などは、たとえ造影剤を用いてもCT・MRIでは難しいケースがある。そのようなとき、CT・MRIを補助する画像診断として、18F-2-fluoro-2-deoxyglucose (18F-FDG)によるPET診断が利用されている。しかし、18F-FDGは、診断メカニズム上ブドウ糖代謝の盛んな正常組織(例えば脳)や急性期の炎症組織に集積するため、脳腫瘍や治療直後の診断などでは使用しにくい。それゆえ、18F-FDGを補完するPET用腫瘍診断剤の研究開発が、近年盛んになっている。
近年注目されている研究途上のPET用腫瘍診断剤として、18F標識チミジン誘導体、18F標識アミノ酸誘導体、18F標識コリン誘導体がある。これらは、それぞれ盛んな細胞増殖に伴って亢進するDNA合成、蛋白質合成、またはコリンの利用に着目した診断剤であり、悪性腫瘍の盛んな細胞増殖を画像化するものである。ここでは、18F標識アミノ酸誘導体について紹介する。これらのトレーサーは、いずれもまだ研究段階にあり、我が国ではまだ日常診療には使用されていない。
18Fは、サイクロトロンで生産される物理的半減期110分の放射性核種であり、ポジトロン(β+)を放出する。β+は、極めて半減期の短い粒子で消滅の際に510keVのγ線を2本反対方向に放射する。この2本のγ線放射を同時に捕らえて画像化する装置がポジトロンエミッショントモグラフィー(PET)であり、核医学画像診断装置の中では定量性や空間分解能に優れる。
1. 研究開発の歴史
画像診断への応用を目指したRI標識アミノ酸の研究は1960年代に始まる。最初はSe-75・I-131・I-123といったSPECT核種で標識された非天然アミノ酸が主流であった。その当時の代表的な化合物は、図1に示す75Se-selenomethionine1)、123I-iodophenylalanine2)、123I-iodotryptophan2)、123I/131I-iodomethyltyrosine3)などである。I-131やI-123は比較的入手が容易であったため、それらによる標識が容易なベンゼン環・複素環を持つアミノ酸が利用された。
その後1970年代後半よりC-11やF-18といったPET核種で標識されたアミノ酸誘導体の研究が始まった。C-11標識体の利点は、1)SPECT核種標識体と違って天然アミノ酸の化学構造そのままであるため、あらゆるアミノ酸を標識することができ、2)それらは蛋白質に取り込まれ、アミノ酸の代謝や蛋白質の合成を画像化できる点にあった。しかし、C-11の物理的半減期(T1/2)20分は、生体内の生化学的過程を追跡するにはあまりにも短すぎたため、もう少し半減期の長いF-18(T1/2=110分)で標識されたアミノ酸誘導体が研究されるようになった。様々な化合物が合成され、標識の容易さや標識収率、半減期に見合ったすばやい体内動態、目的臓器や病巣への高い取り込み率、非特異的分布の低さ、といった観点から化合物が絞り込まれた。スクリーニングで生き残ったアミノ酸誘導体は、実際にはそれほど多くない。図1に代表的なRI標識アミノ酸誘導体の研究報告の年代を示した。
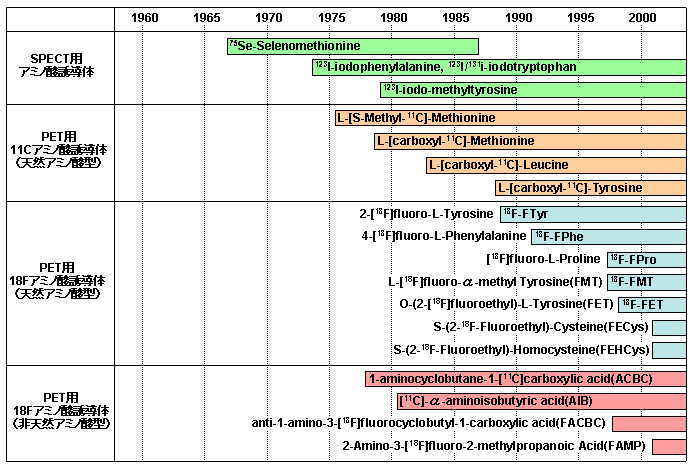
図1 アミノ酸誘導体研究の歴史
アミノ酸は、生体内では主に蛋白質合成の盛んな細胞で多量に消費される。組織や臓器で言えば、消化酵素を大量に合成する膵臓、細胞増殖が盛んな組織及び腫瘍である。歴史的に生き残っているRI標識アミノ酸誘導体は、いずれも単なる受動拡散で生体内に均一に分布するような挙動はとらず、高いアミノ酸代謝を反映した画像を与える。膵臓へも高い取り込みを示すため、初期の75Se-selenomethionineでは、膵臓疾患の画像診断の可能性が研究された。腫瘍の画像診断の可能性は1960年代から認識されており1)、研究の過程で腫瘍への取り込み率が高い有望な化合物が見出された。その代表的化合物を図2に示した。これらは、いずれも生体内では蛋白質合成には利用されない非天然型アミノ酸だが、多くは天然型アミノ酸と同様に細胞膜上のアミノ酸トランスポート系により細胞内に輸送されると考えられる。
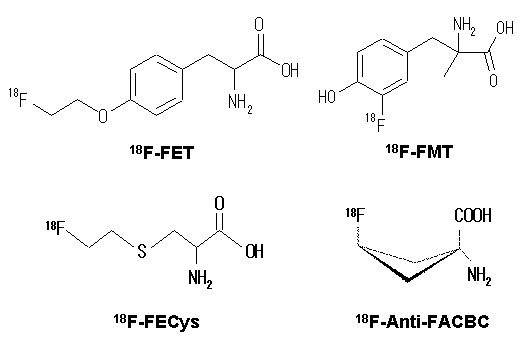
図2 腫瘍診断剤として有望な18F標識アミノ酸誘導体の化学構造
2. 8F標識アミノ酸誘導体のがんへの集積機序
アミノ酸は、細胞膜上に存在するアミノ酸輸送チャネルであるアミノ酸トランスポータを介して細胞内に輸送される。アミノ酸トランスポータは現在まで30種類程度知られており、それぞれのアミノ酸トランスポータは輸送するアミノ酸の種類が違う。
今まで報告された非天然型アミノ酸のうちアミノ酸トランスポータに対する選択性の高い化合物は、α-aminocyclobutane carboxylic acid(ACBC)、α-aminocyclopetane carboxylic acid(ACPC) α-aminoisobutyric acid(AIB)などである。Washburnらは、このうち11C-ACBCが最も選択的に細胞内に取り込まれることを動物実験で示した4)。この化合物を用いて星状細胞腫患者を対象に行った臨床試験でも、高い腫瘍取り込みと低いバックグラウンド(=正常脳組織への低い集積)が観察された。これらの知見をもとに、より半減期が長く使いやすいF-18化合物の研究がGoodmanらによって行われ、18F-FACBCが生まれた(原論文1)。
18F-FACBCが、どのように血液脳関門を通過し細胞内へ輸送されるのか、まだ完全に明らかにはなっていない。18F-FACBCの細胞内への集積程度は、非天然型中性アミノ酸の中では、Na依存性アラニントランスポート系(A-system)を経て取り込まれるAIBと、Na非依存性平衡ロイシントランスポート系(L-system)を経て取り込まれるcycloleucineの中間に位置する。18F-FACBCは、これら複数のアミノ酸トランスポート系により細胞内に取り込まれるものと推測される。
3. 18F標識アミノ酸の臨床研究
18F-FACBCの臨床研究の結果を図3に紹介する。この例は、神経膠芽腫患者を対象に行った試験において、Gd造影MRIでは神経膠芽腫の広がりを正しく診断できず、腫瘍の切除が失敗に終わった患者である。この患者は、上段のGd造影MRI/T1強調画像(頭部横断像)で左前頭葉に腫瘍が広がっていることが分かる。脳腫瘍の位置を確認して手術を行ったが、手術1週間後に実施した18F-FACBCイメージング(下段)で、はっきりとした異常集積を認めた。手術8週間後に実施した18F-FDGイメージング(中段)では、18F-FDGが正常脳組織に集積するため、腫瘍の存在は明瞭に指摘できない。下段の異常集積部分は、再手術により神経膠芽腫の遺残と確認された。
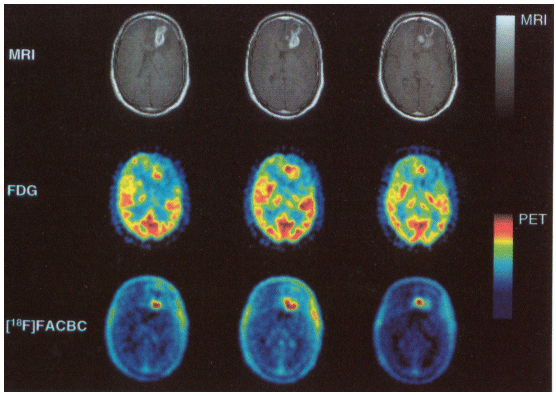
図3 神経膠芽腫患者における18F-FACBCイメージング
上段:手術前のGd造影MRI/T1強調像(頭部横断像)。
中段:手術8週間後の18F-FDG像。患者に370MBq投与後45〜70分に撮像。
下段:手術1週間後の18F-FACBC像。患者に222MBq投与し、dynamic撮像後に画像を再構成した。(原論文1より引用)
18F-FETの臨床研究の結果を図4に紹介する。この例は、星状細胞腫患者を対象に行ったものである。Gd造影MRI/T1強調像では腫瘍の再発が判然としないが(図4 A)、18F-FETイメージングでは明らかに異常集積を認めた。このトレーサーの興味深い点は、体幹部臓器への集積が低い点にある。脳腫瘍以外への応用も考えられる。
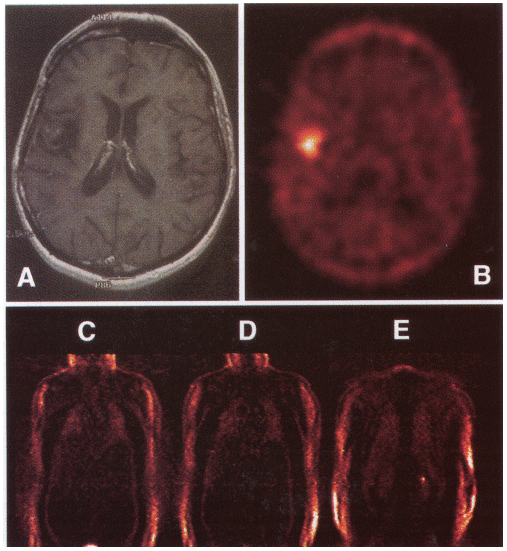
図4 再発した星状細胞腫患者における18F-FETイメージング
上段A:Gd造影MRI/T1強調像(頭部横断像)。
上段B:頭部の18F-FET像。患者に18F-FET 296MBq投与後45〜60分に撮像。
下段C〜E:体幹部前面像、C→Eに向かって背面に至る。(原論文2より引用)
これらの試験結果から明らかなとおり、18F-フルオロアミノ酸は、従来の診断剤では困難な腫瘍診断において有用性が期待されている。
原論文1 Data source 1:
Synthesis and evaluation of [18F]1-amino-3-fluorocyclobutane-1-carboxylic acid to image brain tumors.
原論文2 Data source 2:
Synthesis and radiopharmacology of O-(2-[18F]fluoroethyl)-L-tyrosine for tumor imaging.
Wester HJ, Herz M, Weber W et al.
J.Nucl.Med.1999;40:205-212
参考資料1 Reference 1:
Scintigraphic demonstration of a parathyroid adenoma with 75Se-methionine.
Grebe SF
Med.Klin.1967;Apr.28 62:17,672-674
参考資料2 Reference 2:
A novel 123I-labeling reagent. XIII. Synthesis and loading-dose effects of 123I-iodophenylalanine and 123I-5- and 6-iodotryptophan.
Lambrecht RM, Atkins H, Elias H et al
J.Nucl.Med.1974;15:863-867
参考資料3 Reference 3:
Accumulation of radio-iodinated L-methyl tyrosine in pancreas of mice: concise communication.
Tisljar U, Kloster G, Ritzel F & Stoecklin G
J.Nucl.Med.1979;20:973-976
参考資料4 Reference 4:
Effect of structure on tumor specificity of alicyclic α-amino acids.
Washburn LC, Sun TT, Anon JB & Hayes R
Cancer Res.1978;38:2271-2273
参考資料5 Reference 5:
Carbon-11-methionine and PET an effective method to image head and neck cancer.
Leskin-Kallio S, Nagren K, Lehikoinen P, Ruotsalainen U et al.
J. Nucl. Med. 1992;33:691-695
キーワード:画像診断, ポジトロンエミッショントモグラフィー, 放射性医薬品, 18F-フルオロアミノ酸,18F-フルオロエチルチロシン, 18F-FACBC, 18F-FET, がん、脳腫瘍, リンパ節転移, アミノ酸代謝, アミノ酸トランスポー
diagnostic imaging, positron emission tomography, PET, radiopharmaceutical, 18F-fluoro-amino acid, 18F-fluoroethyltyrosine, cancer, brain tumor, lymph node metastasis, amino acid metabolism, amino acid transporter
分類コード:030502, 030301, 030403
放射線利用技術データベースのメインページへ


