放射線利用技術データベースのメインページへ
作成: 2003/12/30 鷲野 弘明
データ番号 :030256
PET用腫瘍診断剤:F-18-フルオロミソニダゾル
目的 :18F-フルオロミソニダゾルに関する研究動向の紹介
放射線の種別 :陽電子
応用分野 :医学、診断
概要 :
がん組織は、微小循環動態上の欠陥等からしばしば低酸素状態に陥る。低酸素状態は、がん細胞の放射線治療に対する感受性を低下させ、がん治療上大きな問題となる。これを改善する方法のひとつとして、低酸素細胞放射線増感剤が1950年代末より研究されてきた。1980年代末に至って、放射線増感剤のひとつミソニダゾルのF-18標識体が、がん組織の低酸素領域の画像診断に応用された。18F-ミソニダゾルは、低酸素領域に選択的に集積し、放射線治療や抗がん剤治療に対する反応性を予測する際に有用な情報を提供すると考えられる。本剤を臨床的に利用するには、本剤のin vivoにおける集積と組織の酸素分圧・放射線感受性・治療効果との相関性を定量的に検証する地道な研究が今後必要である。
詳細説明 :
19世紀末にX線が発見されると、それほど時をおかずして、放射線照射が生体組織に悪影響を与えることが知られるようになった。1900年代初めには、すでに放射線をがん治療に応用する研究が行われている。そして、1930年代中頃には、組織中の低酸素濃度が放射線の致死効果に影響を与えることが明らかになった。酸素は、細胞が生きていくためには必須の分子でありながら、放射線の致死効果を最大限に高める存在でもある。放射線治療における酸素の役割を肩代わりする薬物=低酸素細胞放射線増感剤が、1950年代末より研究されて来た。放射線増感剤は現在に至るも医薬品として実現していないが、それらのひとつミソニダゾルは、1980年代末にがん及び心臓・脳虚血性疾患における低酸素領域の核医学画像診断に応用された。18F標識ミソニダゾルは、低酸素状態にある細胞内で酸素分圧に反比例する形で細胞構成成分と共有結合する。この過程は酵素反応が媒介しており、従って死んだ細胞内では起こらない。18F標識ミソニダゾルは、低酸素領域に選択的に分布すると考えられ、がんの放射線治療の効果予測に役立てようとする研究が行われている。
18Fは、サイクロトロンで生産される物理的半減期110分の放射性核種であり、ポジトロン(β+)を放出する。β+は、極めて半減期の短い粒子で消滅の際に510keVのγ線を2本反対方向に放射する。この2本のγ線放射を同時に捕らえて画像化する装置がポジトロンエミッションCT(PET)である。PETは、核医学画像診断装置の中では定量性や空間分解能に優れる。
1. がんの低酸素状態
がんとは、その遺伝子の変異・欠落が原因となって発生組織や臓器に固有の細胞増殖制御から逸脱し、勝手に増殖を続ける細胞集団である。がん組織は、発生元組織が本来有する機能や組織構築を欠いているため、様々な点で正常組織と異なった特徴を呈する。例えば、がん組織が増殖に伴って大きくなっても、その細胞集団を支える結合組織・血管系・リンパ管系の構築は、正常組織を正しく模倣していない。こうした結果生まれる特徴のひとつに“低酸素状態(hypoxia)"がある。
多くのがん組織では、増殖初期の段階で毛細血管を周辺組織より引き込み、新たな血管系を構築するが(腫瘍血管新生)、リンパ管系は必ずしも構築しない。細動脈から伝わる血圧を駆動力として毛細血管から滲出した血漿成分は、正常組織では通常静脈とリンパ管に回収されるが、リンパ管系がないがん組織ではその分の回収はなく、周辺組織へ流れ出すことでバランスをとっている。しかし、がん組織が数mmの大きさに成長するころには、このバランスも維持できなくなり、がん組織の組織圧が亢進する。がんが“しこり”として知覚されるのは、この組織圧亢進が背景にある。組織圧の亢進は、酸素や栄養の供給を推進する動脈圧を相殺し、静脈圧を超えれば静脈閉塞〜血流停止を引き起こす。がん組織では、こうして成長とともにその中心部より血液循環の低下〜酸素・栄養素供給の減少が不均一に発生する。低酸素状態とは、酸素の供給が細胞の消費に追いつかない結果起こる動的な酸素需給バランスの崩壊を指す。
がん組織の低酸素状態は、がんの大きさ・壊死の程度・ヘモグロビンの状態などには依存しない。一方で、がんの侵襲性を増し、転移を促し、時にはがん細胞の増殖を刺激し、放射線や抗がん剤に対する感受性を低下させるため、低酸素状態はがん治療の予後を左右する重要な因子である1)。
2. 低酸素状態がもたらすがんの放射線感受性の低下
がんの治療には、手術・血流遮断・放射線照射・抗がん剤・レーザー照射・加熱など、様々な方法があり、現在ではこれらを適切に組み合わせた集学的治療が行われる。放射線療法は、その中でも最も歴史が古い治療法のひとつであり、かつ広く利用されているが、低酸素状態にあるがん細胞に対する致死効果は酸素存在下と比較して低いという欠点を持つ。これを放射線感受性で比較すると、正常酸素分圧(数10 mmHg)のときの放射線感受性は、無酸素状態(0 mmHg)では約1/3に低下する(30〜0 mmHgの領域で放射線感受性は大きく低下する) 2)。細胞の放射線感受性が低酸素状態でなぜ低くなるのか、そのメカニズムが研究されてきたが、未だ結論には至っていない。しかし、治療効果を高めがん再発を防ぐため低酸素下での放射線感受性を高める方法、例えば、高気圧酸素療法と放射線照射の組み合わせや2)、酸素の効果を模倣する医薬品(低酸素細胞放射線増感剤)の研究開発が行われた3)。図1に、悪性神経膠腫における低酸素領域の割合及び酸素分圧と放射線感受性の関係(図1.A)、高気圧酸素療法と放射線治療の組み合わせにおける組織酸素濃度のコントロールの例(図1.B)を示す。細胞の放射線感受性は10 mmHg以下で大きく低下するが、がん組織中で酸素分圧<10 mmHg以下の領域は相当あることが示されている。がん組織の酸素分圧を高める試みとして、患者を高圧酸素室に30分程度静置する方法がある。そこから出た後30分以内に放射線を照射すれば、がん組織の酸素分圧は放射線感受性を維持できる程度に十分高く、かつ高圧酸素暴露中の放射線照射による副作用もない2)。
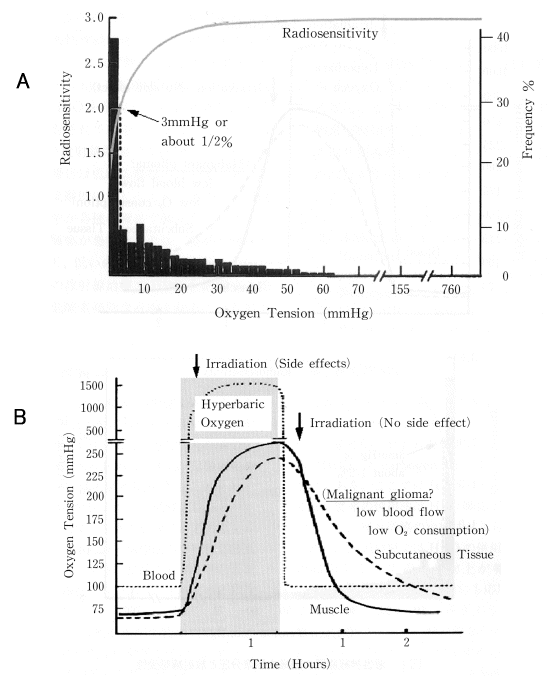
図1 悪性神経膠腫における低酸素領域の割合及び酸素分圧と放射線感受性の関係(A)。
高気圧酸素療法と放射線治療の組み合わせにおける組織酸素濃度のコントロール例(B)。
(原論文1より引用)
3. 低酸素細胞放射線増感剤の研究
1955年中村らは、嫌気的環境下で増殖する細菌やプロトゾアに対して有効な抗生物質azomycin(5-ニトロイミダゾル誘導体)を発見した。低酸素下で効力を発揮するニトロイミダゾル誘導体の特異な生物学的効果は、やがて低酸素下におけるがん細胞の放射線感受性や薬剤感受性を高める増感剤の開発にヒントを与えた。低酸素細胞放射線増感剤(以下放射線増感剤)の本格的研究は、1950年末より始まったと言えるだろう4)。1970〜1980年代には放射線増感作用を示す様々な化合物をがん治療に応用すべく研究されたが、ミソニダゾルは1974年にAsquithらによって見出された5)。その化学構造を図2に示す。ミソニダゾルは、医薬品としての承認を得るべく臨床試験が実施されたが、副作用等の問題で開発中止となった。放射線増感剤については、その後現在に至るまで様々な改良を試みる研究開発が継続されている。
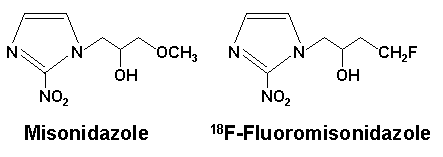
図2 ミソニダゾル及び18F標識ミソニダゾルの化学構造。
4. 低酸素細胞の画像化の試み
がん組織の酸素濃度を測れば放射線や抗がん剤による治療の効果を予測しうるとの考え方から、酸素電極をがん組織に刺し込んで酸素濃度を測定する研究が行われた。がん組織の酸素分圧は、正常組織の平均的な酸素分圧(数10 mmHg)と比較してかなり低く、低酸素状態(5 mmHg以下)の領域は、がんによってはその体積の半分以上にも及ぶ6)。しかし、電極を患部に刺し込むことは常に容易とは限らず、更に刺し込んだ場所の酸素分圧しかわからない。それゆえ、がん組織の局所酸素分圧をがん全体で非侵襲的に測定できることが望まれる。
RI標識放射線増感剤を用いて非侵襲的に低酸素状態を評価できないかというアイデアは、すでに1981年には議論されている7)。その後、ミソニダゾルはin vitro実験系において低酸素状態に置かれたがん細胞内で酵素的に還元されて細胞構成成分に共有結合することが示された8)。また、この結合は、酸素分圧に逆比例することも分かった9)。ミソニダゾルの細胞成分への結合は酸素分圧が3 mmHg以下で起こり、結合反応にかかわる官能基はニトロ基であり、ニトロ基が還元されてラジカルを生成しそれが細胞構成成分と結合すると考えられる。画像診断への応用は、ワシントン大学(シアトル市・米国)の研究グループによる18F-フルオロミソニダゾル(18F-FMISO)の研究に負うところが大きい10)。
5. 18F-フルオロミソニダゾルによる臨床研究
18F-FMISOの臨床研究は1990年代以降散見される。その例を以下図3〜4に紹介する。
図3の症例は鼻咽頭がん患者(扁平上皮がん)で、放射線治療前には鼻咽頭部に大きながん病巣があり、この18F-FMISOの画像は投与2時間後の像である。病変部位の18F-FMISO集積を後頭部下の正常筋肉組織(=酸素が十分行き渡っている組織)と比較すると、筋組織の6.82倍の集積があった。当該患者はこの結果に基づいて放射線治療を受け、治療6ヶ月後に再度18F-FMISOによる診断を受けた。最初にがんがあった場所にはもはや異常集積は認められず、がんの消失を示唆するその他の診断結果と一致した。
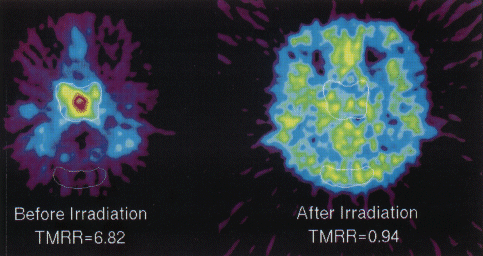
図3 鼻咽頭がん患者における18F-FMISOイメージング。
(原論文2より引用)
図4の症例は、同一骨肉腫患者において18F-FMISOと18F-フルオロデオキシグルコース(FDG)のイメージを比較検討している。病変は右大腿部にあり、18F-FDGはその部位に一致して高い集積を示しているが、18F-FMISOは必ずしも集積しているわけではない。3段目の“FMISO image”で赤く表示された部分は、18F-FMISOの病変部位における単位体積あたりの放射能集積が血液のそれより1.2倍以上あった部分であり、低酸素状態にある組織と考えられる。一見して明らかなとおり、両者の間に相関性のある集積兆候はない。両者のPixelカウントの相関性を分析した結果(下段“FDG vs FMISO”)も、その見方を支持する。18F-FMISOは18F-FDGと本質的に異なる情報を与えることが分かるが、その臨床的意義を証明することは容易ではない。
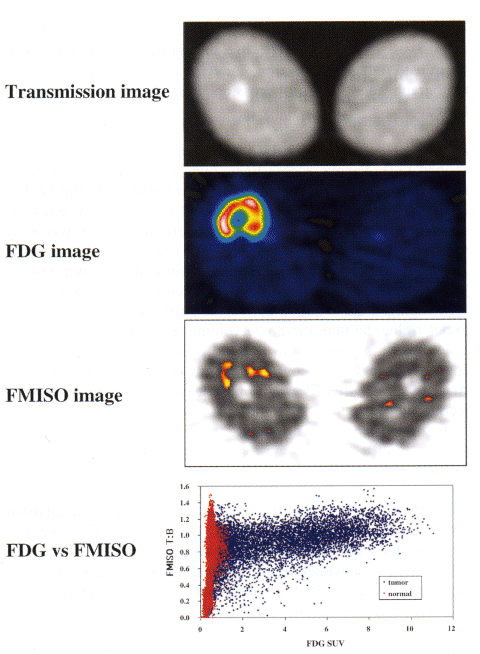
図4 骨肉腫患者における18F-FDGと18F-FMISOイメージング。
Transmission image: 右大腿部の骨肉腫病変のX線像。
FDG image:上記部位の18F-FDG横断像。
FMISO image: 上記部位の18F-FMISO横断像。
FDG vs FMISO:FDGとFMISOの集積相関性に関するpixel-by-pixel分析。(原論文3より引用)
がん組織における低酸素状態の評価は、治療方針の決定や予後予測に役立つ。しかし、それを臨床現場で高い再現性を持って測定することは容易ではない。ここで紹介した18F-FMISOによる低酸素状態の画像診断は、こうした要請に応える技術と言える。しかし、18F-FMISOによる画像診断の問題点は、in vivoにおいて集積程度と酸素分圧の関係をキャリブレートすることが難しい点にある。また、患者個々の18F-FMISO画像解析の結果を治療成績と対比検討し、18F-FMISO画像が与える臨床的意義を見い出す地道な研究の積み重ねも必要である。
原論文1 Data source 1:
抗腫瘍効果と高気圧酸素−放射線療法との併用−
合志, 植村, 木下 他
産業医科大
日本高気圧環境医学会雑誌 1997; 31:199-204
原論文2 Data source 2:
Fluorine-18 fluoromisonidazole tumour to muscle retention ratio for the detection of hypoxia in nasopharyngeal carcinoma.
Yeh SH, Liu RS, Wu LC et al.
Eur J Nucl Med 1996; 23:1378-1383\\703)原論文3
[18F]FMISO and [18F]FDG PET imaging in soft tissue sarcoma: correlation of hypoxia, metabolism and VEGF expression.
Rajendran JG, Wilson DC, Conrad EU et al.
Eur J Nucl Med Mol Imaging 2003; 30:695-704
原論文3 Data source 3:
[18F]FMISO and [18F]FDG PET imaging in soft tissue sarcoma: correlation of hypoxia, metabolism and VEGF expression.
Rajendran JG, Wilson DC, Conrad EU et al.
Eur J Nucl Med Mol Imaging 2003; 30:695-704
参考資料1 Reference 1:
[18F]FMISO and [18F]FDG PET imaging in soft tissue sarcoma: correlation of hypoxia, metabolism and VEGF expression.
Rajendran JG, Wilson DC, Conrad EU et al.
Eur J Nucl Med Mol Imaging 2003; 30:695-704.
参考資料2 Reference 2:
抗腫瘍効果と高気圧酸素−放射線療法との併用−
合志, 植村, 木下 他.
日本高気圧環境医学会雑誌 1997; 31:199-204.
参考資料3 Reference 3:
Hypoxic cell radiosensitizers: Where next?
Brown JM.
Int J Radiat Oncol Biol Phys 1989; 16:987-993.
参考資料4 Reference 4:
Radiation Protection and Sensitization.
Moroson HL & Quintiliani M.
Taylor & Francis, London, 1969.
参考資料5 Reference 5:
Electron affinic sensitization. V. Radiosensitization of hypoxic bacteria and mammalian cells in vitro by some nitroimidazoles and nitropyrazoles.
Asquith JC, Watts ME, Patel K et al.
Radiat Res 1974; 60:108-118
参考資料6 Reference 6:
Patterns and variability of tumor oxygenation in human soft tissue sarcomas, cervical carcinomas, and lymph node metastases.
Brizel DM, Rosner GL, Prosnitz LR et al.
Int J Radiat Oncol Biol Phys 1995; 32:1121-1125.
参考資料7 Reference 7:
A marker for hypoxic cells in tumours with potential clinical applicability.
Chapman JD, Franko AJ & Sharplin AJ.
Br J Cancer 1981; 43:546-550.
参考資料8 Reference 8:
Characteristics of the metabolism-induced binding of misonidazole to hypoxic mammalian cells.
Chapman JD, Baer K & Lee J.
Cancer Res 1983; 43:1523-1528.
参考資料9 Reference 9:
Metabolism induced binding of C-14 misonidazole to hypoxic cells: kinetic dependence on oxygen concentration and misonidazole concentration.
Koch CJ, Stobbe CC & Baer.
Int J Radiat Ocol Biol Phys 1983; 10:1327-1332.
参考資料10 Reference 10:
Radiolabeled fluoromisonidazole as an imaging agent for tumor hypoxia.
Rasey JS, Koh W, Grierson JR et al.
Int J Radiat Oncol Bio Phys 1989; 17:985-991.
キーワード:画像診断, ポジトロンエミッショントモグラフィー, 放射性医薬品, 低酸素細胞放射線増感剤, ニトロイミダゾル, 18F-フルオロミソニダゾル, 電子親和性, 低酸素状態、低酸素細胞, 高気圧酸素療法, 脳腫瘍, 頭頚部がん,
diagnostic imaging, positron emission tomography, PET, radiopharmaceutical, hypoxic cell radiosensitizer, nitroimidazole, 18F-fluoromisonidazole, electron affinity, hypoxia, hypoxic cell, hyperbaric oxygen therapy, brain tumor, head and neck cancer,
分類コード:030502, 030301, 030403
放射線利用技術データベースのメインページへ


