放射線利用技術データベースのメインページへ
作成: 2003/12/30 鷲野 弘明
データ番号 :030245
PET用腫瘍診断剤:C-11/F-18標識コリン誘導体
目的 :11C-コリン/18F-フルオロコリンに関する研究動向の紹介
放射線の種別 :陽電子
応用分野 :医学、診断
概要 :
11C-コリンや18F-フルオロコリン等のRI標識コリン誘導体は、近年再び注目されるPET用診断剤であり、CTやMRIでは診断しにくい腫瘍への適用が研究されている。これらコリン誘導体は、腫瘍細胞などにおけるコリン代謝の亢進を反映して細胞内に取り込まれ、細胞増殖を画像化すると考えられる。11C-コリンは、特に18F-FDGが有効ではない脳腫瘍や前立腺がんなどへの応用が検討されている。11C-コリンは、11Cの超短半減期ゆえに商業化は困難だが、18F-フルオロコリンは可能であり、今後の進展が期待される。
詳細説明 :
腫瘍の画像診断は、通常CTやMRIで行われる。しかし、良性/悪性の鑑別・手術後再発の診断・他病変との鑑別などは、たとえ造影剤を用いてもCT・MRIでは難しいケースがある。そのようなとき、CT・MRIを補助する画像診断として、18F-2-fluoro-2-deoxyglucose (18F-FDG)によるPET診断が利用されている。しかし、18F-FDGは、診断メカニズム上ブドウ糖代謝の盛んな正常組織(例えば脳)や急性期の炎症組織に集積するため、脳腫瘍や治療直後の診断などには使用しにくい。それゆえ、18F-FDGを補完するPET用腫瘍診断剤の研究開発が、近年盛んになっている。
近年注目されている研究途上のPET用腫瘍診断剤として、18F標識チミジン誘導体、18F標識アミノ酸誘導体、18F標識コリン誘導体がある。これらは、それぞれ盛んな細胞増殖に伴って亢進するDNA合成、蛋白質合成、またはコリンの利用に着目した診断剤であり、悪性腫瘍の盛んな細胞増殖を画像化するものである。ここでは、11C/18F標識コリン誘導体について紹介する。これらのトレーサーは、いずれもまだ研究段階にあり、我が国ではまだ日常診療には使用されていない。
18Fは、サイクロトロンで生産される物理的半減期110分の放射性核種であり、ポジトロン(β+)を放出する。β+は、極めて半減期の短い粒子で消滅の際に510keVのγ線を2本反対方向に放射する。この2本のγ線放射を同時に捕らえて画像化する装置がポジトロンエミッショントモグラフィー(PET)であり、核医学画像診断装置の中では定量性や空間分解能に優れる。
1. 研究開発の歴史
RI標識コリン誘導体の研究は、1980年代初めに遡る。11C-コリンは、最初はアルツハイマー病の画像診断を行うことを目的としてFriedlandらにより合成された1)。コリンはアセチルコリン前駆体として大脳のアセチルコリン作動性神経細胞に取り込まれると考えられ、11C-コリンは神経細胞の代謝機能の画像化を目指して合成された。その後1990年代になって、11C-コリンが腫瘍診断剤になり得ることに着目し報告したのは、Haraら日本人研究者である2)。彼らは、最初11C-choline標識コリンで脳腫瘍や前立腺がんの画像診断の研究を開始し、さらに実用性の高い18F-フルオロコリン誘導体へと進み、この領域の研究を切り開いた。
2. コリン誘導体のがんへの集積機序
コリンの腫瘍組織における動態は、多くのMR spectroscopyや生化学的研究から明らかになりつつある。即ち、活発な細胞分裂を繰り返す腫瘍細胞では、コリンキナーゼ活性が亢進し、choline, phosphocholine, phosphoethanolamineの細胞内濃度が上昇している。これらは、細胞膜の構成成分であるリン脂質の合成亢進と符合する。コリン代謝の亢進は、脳腫瘍・前立腺がん・乳がんなどで示されている3,4)。
RI標識コリン誘導体の例を図1に示す。
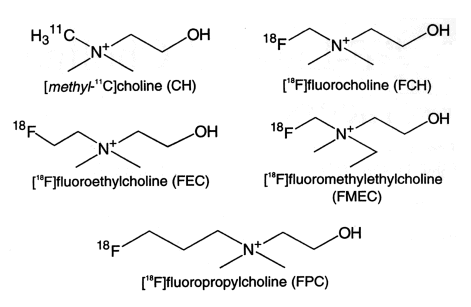
図1 18F-フルオロコリン誘導体の化学構造。(原論文1より引用)
コリンは細胞内に取り込まれた後、コリンキナーゼによってリン酸化され、マイナスの電荷が付与される。このマイナス電荷は、リン酸化されて細胞内にトラップされる18F-FDGの場合と同様に、RI標識コリンの細胞外への透過拡散を阻止し(=metabolic trappingとよぶ)、これによってRI標識コリンが腫瘍組織に高濃度に集積すると推察される。In vitro細胞実験の結果では、図1のFCHはコリンとほぼ同程度にリン酸化されるが、FECとFPCはコリンの各々30%及び60%程度である。
11C-コリンは、投与後2分程度で速やかに血液中より消失し、肝臓に集積し腹腔内には滞留するものの脳・肺・心臓・筋肉・骨などには集積しないため、腹部以外の部位、即ち頭頚部・胸部・四肢では優れたコントラストが得られる。前立腺のイメージングは、投与2分後から尿中排泄放射能が膀胱に到達する4分後の2分間である。
3. 11C-コリン・18F-フルオロコリンの臨床研究
以下図2に11C-コリンと18F-FDGによる前立腺がん(未分化型腺がん)の画像診断比較例を紹介する。この患者は、腰椎・坐骨・腸骨・恥骨に前立腺がんの骨転移を認め、骨盤腔内の多くのリンパ節に腫張を認めた。11C-コリンは、これらの転移部位や異常部位へ集積していたが、18F-FDGはあまり集積していない(A、B)。この患者はホルモン療法を受け、PSAは治療前の3054から3ヵ月後の11.1に激減し、CTで前立腺容積の縮小が確認された。しかし、3ヵ月後の11C-コリンイメージングは、前立腺周辺の他臓器へのがん浸潤〜転移が確認された(C)。浸潤〜転移拡大の様相は、18F-FDGでは良く分からない(D)。
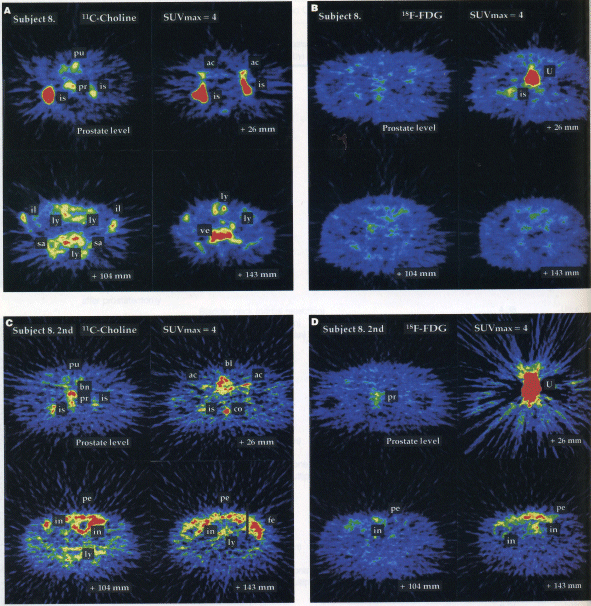
図2 前立腺がん患者における11C-コリンと18F-FDGの画像の比較。A:ホルモン療法前の11C-コリンの画像。B:ホルモン療法前の18F-FDGの画像。C:ホルモン療法中の11C-コリンの画像。D:ホルモン療法中の18F-FDGの画像。画像はすべて骨盤部横断像で、“prostate level”のスライス位置は前立腺の位置に相当し、“+26 mm”〜“+143 mm”はそこから26〜143 mm上腹部のスライス位置を示す。Is;坐骨、pu;恥骨、ac;寛骨臼、il;腸骨、sa;仙骨、ve;腰椎、ly;リンパ節、in;小腸壁、pe;腹膜、fe;腸内容物。(原論文2より引用)
以下図3に18F-フルオロコリン(18F-FCH)を前立腺がん患者に投与した結果を紹介する。上段の図Aは投与2〜4分における骨盤部のPET画像(縦断像)である。前立腺部位に相当する異常集積が見られる。18F-FCHの血中消失は極めて速く、投与後2分以内にピークレベルの5%以下にまで落ちる。そのため、投与直後より放射能が血液から消失し腎臓を経て膀胱内に届くまで間、骨盤腔を観察することができる。こ4分間の様子は、中段図Bの時間-放射能曲線が示しており、2〜4分の2分間が絶好の観察時間帯である。この患者の全身像は、図Cに示した。この画像より、縦隔領域に異常集積が認められ、この部位のリンパ節への転移が疑われた。
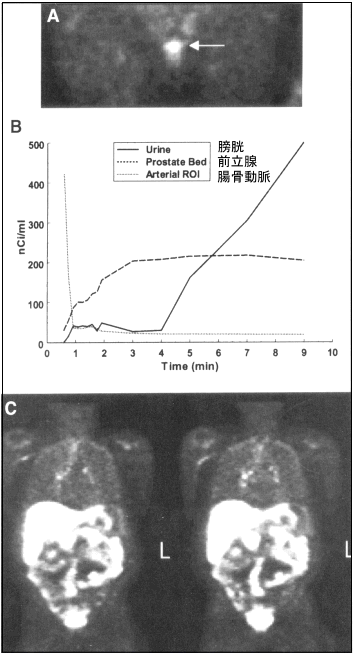
図3 前立腺がん患者における18F-FCHの画像。A:投与2〜4分後における骨盤腔のイメージ。前立腺の部位に一致して異常集積が認められる。B:図Aにおける各領域の時間−放射能曲線。膀胱(Urine)、前立腺(Prostate Bed)、腸骨動脈(Arterial ROI)C:体幹部のイメージ。(原論文1より引用)
以下図4に乳癌患者を対象に18F-FCHイメージングと18F-FDGイメージングを行った例を示す。上段の18F-FDGでは、心臓への集積が見られ、下段の18F-FCHでは唾液腺・肝臓・腎臓などへの集積が見られる。これらは、いずれも各トレーサー特有の正常臓器への分布である。FCH及びFDGは、ともに胸骨への大きな転移、右肺門及び気管傍リンパ節への転移、右前方の骨盤への転移を示している。しかし、リンパ節転移の描出能力はFCHの方が高い(図4下段FCH-PETにおける矢印がリンパ節転移を示す)。
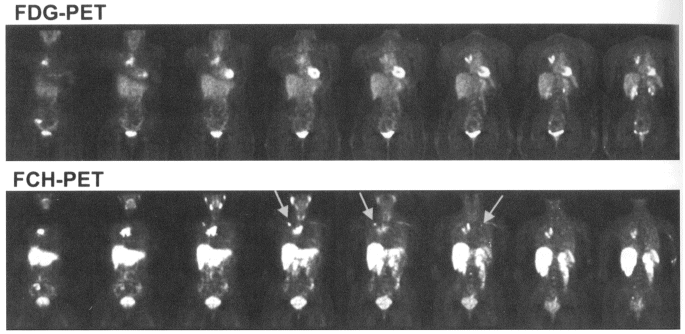
図4 乳がん患者における18F-FCHと18F-FDGの画像の比較。上段:18F-FDG、下段:18F-FCH。(原論文1より引用)
これらの研究例から明らかなとおり、11C-コリンや18F-フルオロコリンは、従来の診断剤では困難な腫瘍診断において有用と考えられる。C-11標識体の場合、C-11の物理的半減期20分ゆえに医薬品としての商業化には多くの困難が伴う。しかし、F-18は商業化が可能な半減期を有しており、18F-フルオロコリンの研究進展が期待される。
原論文1 Data source 1:
Synthesis and evaluation of 18F-labeled choline analogs as oncologic PET tracers
DeGrado TR, Baldwin SW, Wang S, Orr MD et al
J Nucl Med 2001;42:1805-1814
原論文2 Data source 2:
PET imaging of prostate cancer using carbon-11choline
Hara H, Kosaka N & Kishi H
J Nucl Med 1998;39:990-995
参考資料1 Reference 1:
Labeled choline and phosphorylcholine: body distribution and brain autoradiography: concise communication
Friedland RP, Mathis CA, Budinger TF et al
J Nucl Med 1983;24:812-815
参考資料2 Reference 2:
PET imaging of brain tumor with [methyl-11C]-choline.
Hara T, Kosaka N, Shinoura N & Kondo T
J Nucl Med 1997;38:842-847
参考資料3 Reference 3:
Analysis of cytosolic phosphoethanolamine and ethanolamine and their correlation with prognostic factors in breast cancer
Kano-Sueoka T, Watanabe T, Miya T & Kasai H
Jpn J Cancer Res 1991;82:829-834
参考資料4 Reference 4:
Brain tumour imaging with carbon-11 choline: comparison with FDG PET and gadolinium-enhanced MR imaging
Ohtani T, Kurihara H, Ishiuchi S et al.
Eur J Nucl Med 2001;28:1664-1670
キーワード:画像診断, ポジトロンエミッショントモグラフィー, 放射性医薬品, 11C-コリン, 18F-フルオロコリン, 脳腫瘍, 乳がん, 肺がん, 前立腺がん, 腫瘍,リンパ節転移, コリン代謝,diagnostic imaging, positron emission tomography, PET, radiopharmaceutical, 11C-choline, 18F-fluorocholine, brain tumor, breast cancer, prostate cancer, tumor, lymph node metastasis, choline metabolism
分類コード:030502, 030301, 030403
放射線利用技術データベースのメインページへ


