������ 2001/1/15 ���� ����
�ǡ����ֹ桡������030228
����ե������г˼�ˤ���������ȱּ���
��Ū������������������ե������г˼��ɸ��������Υ������ʥ빳�Τˤ��⼣�ŤξҲ�
�������μ��̡���������ե���,�١�����
����ʬ�����������ء�����
���ס�������������
����ե������г˼��ɸ�����줿��Υ������ʥ빳�Τ��������������פι�����ޤȤ��Ƹ��椵��Ƥ��롣����ϡ��γ�������������ȼͤ��뽾�����������ˡ�Ȱۤʤꡢ����ե������г˼��ɸ�����줿���Τ��������Ϳ�������⤫����������ȼͤ��뼣��ˡ(�����ȱּ���)�Ǥ��롣���ߡ����Ѳ�����ĤĤ��������ȱּ��Ťϡ�131I��90Y�ʤɤΥ١��������г˼���Ѥ��������оݤ����������������⤤���硢��ۥ�������Ѽ�˸��ꤵ��Ƥ��롣����ե����ϡ��١���������٤ƤϤ뤫�˹⤤��ʪ��Ū���̤�����������оݤϤ�깭����ǽ�������뤿�ᡢ����ե������г˼�����Ѥ��븦�椬��ƻ��³�����Ƥ��롣
�ܺ���������������
1. ����ե�������ʪ��Ū����
������ե����ϡ�ñ��⥨�ͥ륮���Υإꥦ�ึ�ҳ�(4He)�Ǥ��ꡢ������Ʊ�̸���(RI)������ե����Ѥ���ݤ����Ф���롣���ߥ���ե����Ѥ���RI�ϡ���˸����ֹ�82�ʾ�νŤ����Ǥǡ���100��ۤ��Τ��Ƥ��롣����ե����κ�Ω�ä���ħ�ϡ����ι⤤�����ͥ륮����Ϳ(linear energy transfer:LET)��û�������ˤ��롣�㤨�С������ȱּ��Ť���ɽŪ�ʥ١����˼�Ǥ���90Y�ȥ���ե��˼異��������-211(211At)����Ӥ���ȼ��Τ褦�ˤʤ롧
��������������LET(keV/��m) �����ȿ����ʿ������(��m)
����Y-90��������0.2�������������� 3960
����At-211������97������������������70
��211At��LET��90Y����٤�500�ܤۤ��礭������ʿ��Ū�˸��äƥ���ե�����LET�ϥ١�������LET��400��(80 keV/��m vs 0.2 keV/��m)�Ϥ��롣���Τ��ᡢ���������ˤ��¸���뤬������ե����κ�˦�Գ貽(��)���Ѥ��Ф�����ʪ��Ū������(RBE)���ˤϣ������Ȥʤ롣In vitro��˦�¸��η�̤ˤ��ȡ��⤷��˦ɽ�̤ǥ���ե����Ѥ���������ե�������˦�ˤ��̲᤹��ȡ����ä����ĤΥ���ե�γ�ҤǺ�˦����Ǥ����뤳�Ȥ���ǽ�ȿ��ꤵ��롣���������١������ξ��ϡ����줬1,000��10,000�Ĥ�ɬ�פȤʤ롣�Ȱ���ɬ���ɤ�����ե����ʤ顢�ȥ��兩��Ȼ����ɤΤ��١������Ȥ����롣�ʤ��Τ褦�ʥ١������Ǥ⡢���������Ť����Ѥ���륬��������RBE���⤯���Ÿ��̤Ϥ褤��
*)��ʪ��Ū������(relative biological effectiveness��RBE)
�ۤʤ������䥨�ͥ륮������Υ�������ˤ��ۼ����̤���ʪ��Ū���̤���Ӥ��뷸�����������ʪ��¡�濫�뤤���ȿ����Ф���Ʊ�����ʪ��Ū���̤�⤿�餹�褦�ʡ������������ȴ���������εۼ����̤�����������롣
������ե����������Ϥ�����û�����㤨��211At��70��m�Ϥ��褽��˦10��ʬ��Ĺ���Ǥ��롣����ϡ�����ե���������Ѥ����¤����Ѥ���ˤ��γ��ȼͤ���Ŭ�ڤǤ��ꡢ����ե��˼�餫����ˡ�Ǽ���ʤɤ��������̤�����Ū�˱�����ˡ��ɬ�ܤǤ��뤳�Ȥ��̣���롣�����ǽФƤ����Τ���1980ǯ��˵�®��ȯŸ������Υ������ʥ빳�Τ����Ѥ��륢���ǥ��Ǥ��롣����ե��˼�������ð�Ū�ʥ�Υ������ʥ빳�Τ˷�礷��������������Ϳ�������Τ��Ϥ�Ƽ����ȿ��ޤDZ��¡��ȼͤ��롢¨�������ȱּ��ŤǤ��롣���Υ��ץ������˴�Ť�������ʸ�������Ǥˤ����Ĥ�ȯɽ����Ƥ��롣
2. �����ȱ���ˡ�ر��Ѥ��ͤ����륢��ե��˼�
����100��Υ���ե��˼�Τ����ºݤ������Ѥ���ˤϡ�¿�������������ɬ�פ����롣���������ȡ�
��Ŭ�ڤʼ��Ÿ��̤�Ϳ����Ⱦ��������äƤ��뤳�ȡ���Ⱦ�����ϡ�û�����Ƥ�Ĺ�����Ƥ⤤���ʤ���
������Ū�����ޤ���¤��������β���Ū������ͭ���뤳�ȡ�
�����Ѥη��������̼�˼郎��������������������������������ʤ����ȡ���Ⱦ������Ĺ��̼�˼郎���ʤɤ�����¡��˽��Ѥ���С�����������ȯ�����礭������Ȥʤ��
���������Ŭ�������ͥ륮���Υ�����������Ф������Ĥ������Ŭ�ڤʥ�����������Ф��ʤ����ȡ�����Ϳ����ˤϡ�����ä�����ʬ�۷���ɬ�ס����Τ���ˤϡ�������Ǥ��뤳�Ȥ�ɬ�ܾ��Ȥʤ롣��
���Ҳ�Ū�˼��������ǽ�ʲ��ʤǡ�ɬ���̤�������������ˡ�����뤳�ȡ���˾�ޤ����ϡ������ͥ졼���������뤤�ϥ��������ȥ����������Ǥ��뤳�ȡ�
�Ȥʤ롣�������Ǥϰʲ���ɽ�˼����褦�ʥ���ե��˼郎����Ȥ��Ƹ�Ƥ����Ƥ��롣
ɽ1�������ȱּ��Ťؤα��Ѥ���Ƥ����Ƥ��륢��ե������г˼�
����ե����г˼��Ⱦ���� ������ˡ
Astatine-211��������7.21 ���� ����ϧ�����������ȥ���
Bismuth-212 60.55 ʬ ����ϧ�������ͥ졼��
Bismuth-213 45.6 ʬ ����ϧ�������ͥ졼��
Lead-212 10.64 ���� ����ϧ�������ͥ졼��
Actinium-225 10.0 �� ����ϧ�������ͥ졼��
Fermium-255 20.1 ���� ����ϧ�������ͥ졼��
Radium-223 11.4 �� ����ϧ�������ͥ졼��
Terbium-149 4 ���� ����ϧ�������ȥ���
�������γ˼�β��ѷ����ʲ��ޣ��˼�����ɽ��γ˼�ϡ����ѷ���β�ή�˰��֤��Ƥ��ꡢ�����Ĺ���ֻ�α������������Ф�³���뤳�Ȥ����ʤ��˼郎����Ƥ��롣
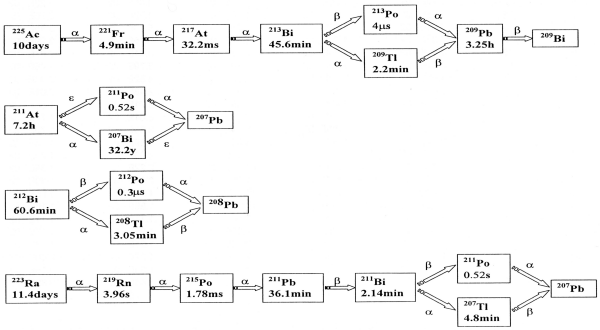
��1������ե������г˼����������ʸ���ʸ1�����ѡ�
3. ����ե��˼�ɸ����Υ������ʥ빳�Τ����ؤα���
��1996ǯ������ե��˼�ɸ����Υ������ʥ빳�Τ����ƿ��Τ���Ϳ���줿������ϡ������ҹ���Ū�˥ҥȷ������줿IgG1����(HuM195)�ˡ���ǽ�����졼�Ⱥ�DTPA��𤷤ƥӥ��ޥ�-213(213Bi)���礷����ΤǤ��ä���HuM195�ϡ��ҥȹ���������¤ǹ�ȯ������CD33�������ð�Ū�˷�礷�������˷�礹���ľ���˺�˦��˼����ޤ�롣ɸ�����Τ�������ǽ(����mg�����������ǽ��)�ϡ�740MBq/mg�Ǥ��ꡢ�̾�ã����ǽ�ʥ�٥�Ȥ����롣
��CD33��ȯ������HL60��˦���Ѥ���in vitro��˦�¸��η�̡���˦�Σ�������213Bi�̤ϡ�ʿ�Ѥ��ƺ�˦���Ĥ�����213Bi���ĤǤ��ꡢ����ͭ���Ǥ��뤳�Ȥ�ʬ���롣
��In vitro�¸��η�̤��Ȥˡ����ͤκ�ȯ�ޤ��ϵ�������������´��Ԥˡ�����ǽ�̤ǹ��10.4, 15.5, 20.7 MBq/kg(��Ϳ���̡�555��1,591 MBq/��)��3��6��/2��4����ʬ������Ϳ���줿�������ν��Ƥ������Ѥ�ȯ�����ʤ��ä��������������������֤ۤɴѻ����줿�����������ϡ���������ŤǤϰ��̤˸����������ѤǤ��롣���Τ����������Ӥ�ɾ�����뤳�Ȥ��Ǥ�������Ǥϡ��������������ι���������º�˦�θ���������졢�����������º�˦�⸺��������
�����θ���ˤ�ꡢ����Ū��ͽ¬���줿����ե����г˼�μ��Ÿ��̤����ƥҥȤǼºݤ˳�ǧ���줿��
�����ȡ���������
����ե��˼�ɸ����Υ������ʥ빳�Τα��Ѥ�ɬ�פ��μ��������ϡ�����10ǯ�֤��礭�����⤷���Ȥ����롣���������ºݤ˾��Ȳ��˻��ޤǤ�ƻ�ϸ�������������ˤ��ɤ��夯�ˤϡ����ʤ��Ȥ�ʲ��Τ褦�ʵ��������������ɬ�פ����롣
������ե��˼�ξ����������ǽ�ˤ�����ˡ�ϡ������ͥ졼��������������Ȥ⥵�������ȥ����������������ʵڤ������̤ϡ��Ҳ�Ū�˼��������ǽ����
������ե��˼�ɸ����Υ������ʥ빳�Τǡ��礭�ʲ��μ�����ŤǤ��뤫������Ȥ�¾����ˡ�Ǥ��ǽ������ξ����ʼ���˸��ꤵ���Τ���
������Υ���ȥ�����ϡ�¾��¡������ؤν���������Ѥʤ��˲�ǽ����
������ե��˼�ϡ����������ˤ����ư�����(����Ū������������ȯ����)������ʤ�����
����ʸ�� Data source 1��
Cellular dose conversion factors for alpha-particle-emitting radionuclides of interest in radionuclide therapy.
K. A. Hamacher, R.B. Den, E.I. Den & G. Sgouros.
J. Nucl. Med. 42, p.1216-1221, 2001
���ͻ����� Reference 1��
Radioimmunotherapy with alpha-emitting nuclides
M.R. McDevitt, G. Sgouros, R.D. Finn, J.L.Humm et al.
Eur. J. Nucl. Med. 25, p.1341-1351, 1998
���ͻ����� Reference 2��
Radiobiology of alpha particles. III. Cell inactivation by alpha-particle traversals of the cell nucleus.
M.R. Raju, Y. Eisen, S. Carpenter & W.C. Inkret.
Radiat. Res. 128, p.204-209, 1991
���ͻ����� Reference 3��
Radionuclides and carrier molecules for therapy.
J. Zweit.
Phys. Med. Biol. 41, p.1905-1914, 1996
���ͻ����� Reference 4��
Radioimmunotherapy with alpha particle-emitting radioimmunoconjugates
M.R. Zalutsky, & D.D. Binger.
Acta Oncol. 35, p.373-379, 1996
���ͻ����� Reference 5��
Potential use of alpha emitting radionuclides in the treatment of cancer.
D.S. Wilbur
Antibody Immunoconj. Radiopharm. 4, p.85-97, 1991
���ͻ����� Reference 6��
Normal organ dosimetry of leukemia patients treated with HuM195 labeled with the alpha particle emitter Bismuth-213.
A.M. Ballangrud, J.L. Humm, M.R. McDevitt, R.D. Finn et al.
J. Nucl. Med. 39(May Suppl), Abstract. No.849, 1998
������ɡ������ȱּ���, ������������, ��Υ������ʥ빳��, ����, �����������, ����ե������г˼�, 211At(������������), 212Bi�ʥӥ��ޥ���������, 213Bi�ʥӥ��ޥ���������, 212Pb�ʱ���������, 225Ac�ʥ������˥��ࣲ������, 255Fm�ʥե���ߥ��ࣲ������, 223Ra�ʥ饸���ࣲ������, 149Tb�ʥƥ�ӥ��ࣱ������, CD33
radioimmunotherapy, radiopharmaceutical, monoclonal antibody, tumor, myelocytic, myelogenic, leukemia, alpha particle-emitter,
ʬ�ॳ���ɡ�030502, 030301, 030403
