作成: 2001/3/20 鷲野 弘明
データ番号 :030209
中枢神経系疾患における神経伝達イメージングの最近研究動向
目的 :中枢神経系疾患を対象とした神経伝達機能のイメージングに関する研究動向の紹介
放射線の種別 :ガンマ線,陽電子
応用分野 :医学、診断
概要 :
中枢神経系の中でも大脳は、高度に発達した神経ネットワークを構築しており、大脳が関わる疾患の病態を理解するには、その神経伝達機能の変化を知ることが肝要となる。大脳を生理学的状態で評価測定する方法には様々なものがあるが、ここでは特に核医学による脳神経伝達機能の画像化に関する近年の研究動向について説明する。
詳細説明 :
1. 中枢神経系の機能の画像化
核医学における画像の際立った特徴は、放射性同位元素で標識された極微量の化学物質(以下 標識体)が通常の覚醒状態で生体内に投与された後、その体内分布を定量的に画像化したものという点に尽きる。これは、他の画像、例えばCTやMRIなどの解剖学的画像と決定的に異なる。極微量の化学物質が、どのようなメカニズムと時間経過で脳内に分布するかによって、その画像の意味するところが決定される。脳の核医学イメージングは、メカニズム的に以下のアプローチがあり得る。
1) 血流状態のイメージング
2) 神経細胞の代謝機能のイメージング
3) 神経伝達機能のイメージング
4) 特定の病態を反映したイメージング
血流状態のイメージングは、脳血流が異常に低下した部位の検出、即ち脳虚血や脳梗塞の診断を目的としており、1980年代に123I-IMP注射液や99mTc-HMPAO注射液として実現した(本データベースで別途紹介)。
神経細胞の代謝機能のイメージングとは、神経細胞のエネルギー代謝や神経伝達物質合成機能の画像化であり、神経細胞のブドウ糖代謝を画像化する18F-FDGやドパミン作動性神経細胞におけるドパミン合成機能を画像化する18F-Fluoro-DOPAなどが代表例である。神経細胞の分布は既に分かっており、脳の特定部位の代謝機能異常を知ることで特定疾患の病態に関する情報が得られる。18F-FDGは、先進諸国ではすでに臨床使用されている(本データベースで別途紹介)。
神経伝達機能のイメージングとは、神経終末(シナプス)における神経伝達の状態を画像化することを指す。大脳には、アセチルコリン、ドパミン、セロトニンなどの神経伝達物質の受容体が存在し、さらに神経伝達機能に関連した様々な受容体やトランスポーターが知られる。これら受容体・トランスポーターに特異的に結合する標識体でイメージングすることにより、その標識体が関連する受容体の脳内分布密度に関する情報が得られ、受容体が関係する疾患の診断に役立つ情報が得られる。1970年代より様々な標識体の研究がなされてきた。
特定の病態を反映したイメージングとは、例えばアルツハイマー病で見られる老人斑や脳腫瘍の局在を画像化するような例である。Chrysamine G誘導体から始まった老人斑イメージングの研究、18F-アミノ酸誘導体を用いた原発性脳腫瘍のイメージングなどは、近年注目される研究である。
2. 神経伝達機能の画像診断
従来より研究されてきた神経伝達機能の画像化の代表例を一覧表としてまとめると、以下のようになろう。表1に示さなかった研究も数多くあり、かなり広範に研究されて来たと言える。これらの化合物は、いずれも神経系が機能している通常の状態で脳の神経伝達機能をそのまま画像化するため、遺伝子診断やCT/MRIといった解剖学的情報しか与えない画像診断とは全く異なる機能情報を提供する。
表1 今までに研究されてきた中枢神経系イメージング剤
---------------------------------------------------------------------------------------
受容体 標識体 画像化の機序 対象疾患
---------------------------------------------------------------------------------------
コリン作動性神経 123I-Epibatidine誘導体 nACh受容体に結合 アルツハイマー病
123I-IBVM ベサミコール受容体に結合
---------------------------------------------------------------------------------------
18F-Fluoro-DOPA ドパミンの合成基質
123I-IBZM D2受容体に結合
ドパミン作動性神経 123I-IBF D2受容体に結合 錐体外路疾患
123I-FP-CIT ドパミントランスポーターに結合 (パーキンソン病)
99mTc-TRODAT ドパミントランスポーターに結合
---------------------------------------------------------------------------------------
123I-R93274 5-HT2A受容体
セロトニン受容体 123I-beta-CIT セロトニントランスポーターに結合 うつ病など
4-Iodotomoxetine セロトニントランスポーターに結合
---------------------------------------------------------------------------------------
muオピオイド受容体 11C-Carfentanil オピオイド受容体への結合
---------------------------------------------------------------------------------------
ベンゾジアゼピン 123I-Iomazenil GABA-A受容体に結合 部分てんかん
18F-flumazenil GABA-A受容体に結合 脳梗塞
---------------------------------------------------------------------------------------
以下に、特に近年注目されている研究成果の一つ99mTc-TRODATによる注意欠陥障害(attention deficit hyperactivity disease,ADHD)患者診断及びChrysamine G誘導体を用いた老人斑の画像化に関する研究について述べる。
3. 集中力欠如多動症の画像診断
99mTc-TRODATはコカイン誘導体で、ドパミン作動性神経のシナプスにおいて、ドパミン放出後にドパミンを節前神経終末に回収するドパミントランスポーターに特異的に結合する。TRODATは、ドパミン作動性神経のシナプス密度を示す指標となる。
最近の米国では、注意欠陥障害(ADHD)が話題となっている。この疾患は、DSM診断基準に特有な注意と衝動コントロールの障害及び過活動を特徴とする精神神経疾患であり、小児に生じしばしば成人まで持続する。米国では、数百万人もの患者がいると言われており、患者の多くが若年齢である。この症状を示す小児の存在は時に学級崩壊の引き金になり、周辺に与える影響の大きさから社会問題化している。ADHD患者には治療薬が投与されるが、治療が最適化されたものかどうか必ずしも明確ではない。最近、ADHD患者におけるドパミン作動性神経の亢進が99mTc-TRODATを用いたイメージングによって示され、治療との関連で注目されている。図1に最近の研究成果を示す。ADHD患者のドパミン作動性神経の機能評価は、治療にひとつの基準を与える可能性があり、治療管理の最適化や副作用軽減が図れるのではないかと期待されている。最近の研究成果を図1に示す。
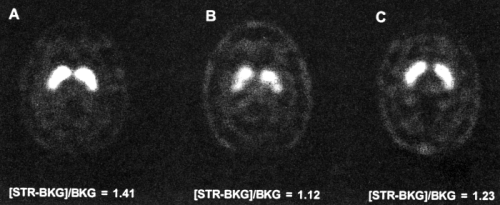
図1 ADHD患者における99mTc-TRODATイメージング(原論文1より引用。 Reproduced from Neuroscience Letters 2000; 285:107-110, Figure 2 (p.108), K-H.Krause, S.H.Dresel, J.Krause, H.F.Kung, K.Tatsch, Increased striatal dopamine transporter in adult patients with attention deficit hyperactivity disorder: effects of methylphenidate as measured by single photon emission computed tomography, Copyright (2000), with permission from Elsevier Science.
)
4. アルツハイマー病の画像診断
アルツハイマー病とは、中年後期に発症し5〜10年で死亡する進行性の変性性脳疾患である。臨床的には、記憶障害・計算障害・視覚空間見当識障害・錯乱・見当識障害などの進行性精神障害が見られ、病理学的には脳の前頭葉・後頭葉・側頭葉の萎縮を特徴とし、組織学的には細胞内神経線維の変形(神経原線維変化)とアミロイドの芯をもつ顆粒状または線維状の好銀性の塊からなる老人斑があり、それらが大脳皮質・扁桃体・海馬に多く見られる。大脳皮質では少数の縮んだ神経細胞をもち、細胞核を周辺に偏位させる細胞質空胞・好銀性顆粒がみられることもある。我が国における患者数は200万人といわれ、最も頻度の高い変性性脳疾患である。
アルツハイマー病では、臨床症状が発現するはるか以前より組織学的な変化が始まることが知られている。こうした変化をより早期に診断し、病気の進行を停止または遅らせることが重要との認識から、アルツハイマー病を特異的に診断する核医学診断剤の研究が行われている。ここにその最近の研究例を紹介する。
Chrysamine Gは、アルツハイマー病に特徴的な老人斑を組織標本上で染色する色素として知られる。この化合物は図2に示すように特徴的な化学構造をしており、それが老人斑に選択的に結合する理由と推察される。この化合物を放射性同位元素で標識しイメージングしようとの研究が現在行われており、基礎的な実験結果を図3に示す。ここから新たなブレイクスルーが見出されるのではないかと期待されている。
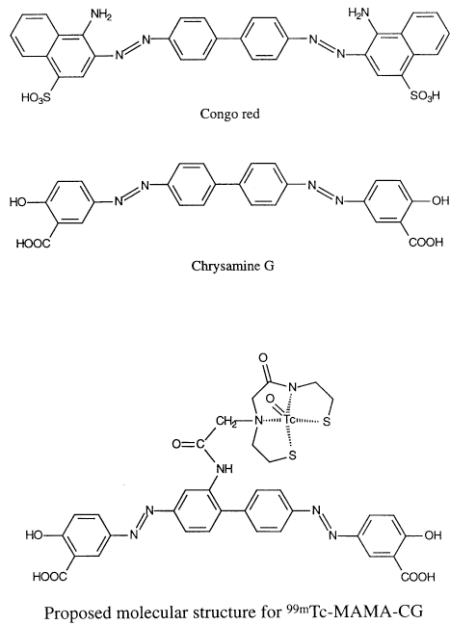
図2 Crysamine G誘導体の化学構造 上:コンゴーレッド、中:Chrysamine G、下:Chrysamine Gの99mTc標識体(原論文2より引用。 Reproduced from European Journal of Nuclear Medicine 1999; 26:1392-1399, Figures 1 and 2 (p.1393), N.A.Dezutter, R.J.Dom, T.J.de Groot, G.M.Bormans, A.M.Verbruggen, 99mTc-MAMA-chrysamine G, a probe for beta-amyloid protein of Alzheimer's disease, Copyright (1999), with permission from Springer-Verlag.
)

図3 99mTc-MAMA-Chrysamine Gによるアルツハイマー病患者脳標本のインビトロオートラジオグラム a) 上段のA)は、アルツハイマー病患者の頭頂葉標本(左側)及び正常人の頭頂葉標本(右側)を用いて行ったインビトロオートラジオグラフィーの結果。99mTc-MAMA-Chrysamine Gが、老人斑の存在するアルツハイマー病患者脳切片(左側)の方に高い結合を示している。下段のB)は、この結合がコンゴーレッドによって阻害されることを示している(下段 左側)。b) 上段A)は、アルツハイマー病患者の後頭葉のオートラジオグラム。A)の一定領域(右側)のコンゴーレッド染色結果は、下段B)に示されており、A)で高い集積を示した領域に一致してコンゴーレッドで染色される老人斑が分布しているのが分かる。(原論文2より引用。 Reproduced from European Journal of Nuclear Medicine 1999; 26:1392-1399, Figure 3 (p.1396), N.A.Dezutter, R.J.Dom, T.J.de Groot, G.M.Bormans, A.M.Verbruggen, 99mTc-MAMA-chrysamine G, a probe for beta-amyloid protein of Alzheimer's disease, Copyright (1999), with permission from Springer-Verlag.)
原論文1 Data source 1:
Increased striatal dopamine transporter in adult patients with attention deficit hyperactivity disorder: effects of methylphenidate as measured by single photon emission computed tomography.
Krause KH, Dresel SH, Krause J, Kung HF, Tatsch K
Neurosci Lett 2000 May 12 285:2, p.107-110
原論文2 Data source 2:
99mTc-MAMA-chrysamine G, a probe for beta-amyloid protein of Alzheimer's disease.
Dezutter NA, Dom RJ, de Groot TJ, Bormans GM, Verbruggen AM
Eur J Nucl Med 1999 Nov 26:11, p.1392-9
参考資料1 Reference 1:
6-[18F]fluoro-A-85380, a novel radioligand for in vivo imaging of central nicotinic acetylcholine receptors.
Horti AG, Chefer SI, Mukhin AG, Koren AO, Gundisch D, Links JM, Kurian V, Dannals RF, London ED
Life Sci 2000 Jun 67:4, p.463-9
参考資料2 Reference 2:
In vivo mapping of cholinergic terminals in normal aging, Alzheimer's disease, and Parkinson's disease.
Kuhl DE, Minoshima S, Fessler JA, Frey KA, Foster NL, Ficaro EP, Wieland DM, Koeppe RA
Ann Neurol 1996 Sep 40:3, p.399-410
参考資料3 Reference 3:
SPECT imaging of dopamine D2 receptors with 123I-IBZM: initial experience in controls and patients with Parkinson's syndrome and Wilson's disease.
Tatsch K, Schwarz J, Oertel WH, Kirsch CM
Nucl Med Commun 1991 Aug 12:8, p.699-707
参考資料4 Reference 4:
Accurate differentiation of parkinsonism and essential tremor using visual assessment of [123I]-FP-CIT SPECT imaging: the [123I]-FP-CIT study group.
Benamer TS, Patterson J, Grosset DG, Booij J, de Bruin K, van Royen E, Speelman JD, Horstink MH, Sips HJ, Dierckx RA, Versijpt J, Decoo D, Van Der Linden C, Hadley DM, Doder M, Lees AJ, Costa DC, Gacinovic S, Oertel WH, Pogarell O, Hoeffken H, Joseph K, Tatsch K, Schwarz J, Ries V
Mov Disord 2000 May 15:3, p.503-510
参考資料5 Reference 5:
Iodine-123 iodobenzofuran (I-123 IBF) SPECT in patients with parkinsonism.
Nakabeppu O, Nakajo M, Mitsuda M, Tsuchimochi S, Tani A, Osame M
Ann Nucl Med 1999 Dec 13:6, p.447-52
参考資料6 Reference 6:
Preclinical evaluation of [123I]R93274 as a SPECT radiotracer for imaging 5-HT2A receptors.
Abi-Dargham A, Zea-Ponce Y, Terriere D, al-Tikriti M, Baldwin RM, Hoffer P, Charney D, Leysen JE, Laruelle M, Mertens J, Innis RB
Eur J Pharmacol 1997 Mar 5 321:3 285-93
参考資料7 Reference 7:
Development of PET/SPECT ligands for the serotonin transporter.
Scheffel U, Dannals RF, Suehiro M, Ricaurte GA, Carroll FI, Kuhar MJ, Wagner HN Jr
NIDA Res Monogr 1994 138, p.111-130
参考資料8 Reference 8:
Reduced GABA A receptor density contralateral to a potentially epileptogenic MRI abnormality in a patient with complex partial seizures.
Kuwert T, Stodieck SR, Puskas C, Diehl B, Puska Z, Schuierer G, Vollet B, Schober O
Eur J Nucl Med 1996 Jan 23:1, p.95-8
参考資料9 Reference 9:
Gender and age influences on human brain mu-opioid receptor binding measured by PET.
Zubieta JK, Dannals RF, Frost JJ
Am J Psychiatry 1999 Jun 156:6, p.842-8
キーワード:中枢神経系, 大脳, 神経伝達, 受容体,アセチルコリン, ドパミン, セロトニン, オピオイド, ベンゾジアゼピン, NMDA, 錐体外路疾患, パーキンソン病, 注意欠陥障害, アルツハイマー病
central nervous system, brain, neurotransmission, receptor, acetyl choline, dopamine, serotonine, opioid, benzodiazepine, NMDA, extrapyramidal disease, Parkinson's disease, attention deficit hyperactivity disease(ADHD), Alzheimer's disease
分類コード:030502, 030301, 030403


