作成: 2006/05/25 伊藤 均、等々力節子
データ番号 :020254
アメリカでのシクロブタノンの変異原性試験
目的 : 多数の微生物変異株を用いての変異原性試験により2−アルキルシクロブタノン類の代表である2−ドデシルシクロブタノンの安全性を明らかにする。
放射線の種別 :エックス線,ガンマ線, 電子線
線量(率) :59kGy
照射条件 :凍結下
応用分野 :食品照射、生薬の照射、飼料の照射
概要 :
2-ACB(2−アルキルシクロブタノン)類には弱変異原性がある可能性が指摘されている。アメリカでは2-ACB類の一種である2-DCB(2−ドデシルシクロブタノン)について微生物突然変異株を用いての変異原性試験が行われた。すなわち、大腸菌のトリプトファン復帰変異、サルモネラによるエームス試験、酵母菌による染色体内組み替え試験、大腸菌によるDNA損傷誘導遺伝子の誘導試験が行われたが、遺伝毒性は認められなかった。
詳細説明 :
1.はじめに
2-ACB(2−アルキルシクロブタノン)類は脂質を多く含む照射食品に生成する放射線に特有な分解生成物として知られている。2-ACB類で最も多く生成するのは2-DCB(2−ドデシルシクロブタノン)であり、図1に示すようにパルミチン酸のアシル基−酸素結合部の放射線による分解作用によって生成する。
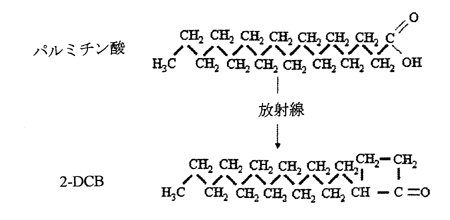
図1 パルミチン酸と2−ドデシルシクロブタノン(2-DCB)の構造。
ドイツの研究によると本データベース020215(放射線特有の分解生成物2−アルキルシクロブタノン類の安全性)に述べているように、ラットおよびヒトの組織培養結腸細胞で2-DCBにDNA鎖切断能があることが示され、弱変異性の可能性が疑われた。2-ACB類は熱に不安定で、生体内への蓄積量が低いことがわかっている。しかし、2-ACB類には結腸癌のプロモーターとして働く可能性も指摘されており(本データベース020232、2−アルキルシクロブタノン類の毒性評価試験−独・仏プロジェクト研究)、一部の消費者団体から食品照射の危険性を示すものであると問題にされた。
ドイツで行われたDNA鎖切断に関する研究は通常の照射牛肉や鶏肉に含まれている2-ACB類の1,000〜10,000倍の濃度で実験したものであり、細胞死が起こる濃度では染色体の切断が起こるとの指摘もある。また、DNA鎖切断の実験は電気泳動によるコメットアッセイ法によるものであり変異原性試験としては不確実な試験法であり、観察された1本鎖切断は生体内で日常的に生じており容易に修復され、突然変異をもたらさないとの指摘もある。
一方、59kGy照射された鶏肉での慢性毒性試験や世代試験、変異原性試験では動物に異常が認められないことから、2-ACB類には変異原性がなく、毒性があっても極微弱であるとの結論が世界保健機関および米国食品医薬品局から出されている。しかし、癌細胞を用いた実験で2-DCB添加によってDNA鎖切断による細胞死が著しく起こるとの報告もあるため、アメリカでは食品添加物の安全性評価に用いられる多くの微生物突然変異株による復帰変異試験等で安全性を確かめた。
2.大腸菌およびサルモネラ変異株の復帰変異による変異原性試験
大腸菌変異株によるトリプトファン復帰変異は短期の遺伝毒性試験(変異原性試験)法として国際的に認められている方法であり、Sommersの研究ではWP2(pKM101)およびWP2uvrA(pKM101)株が試験に用いられた。2-DCBは0.05〜1.0mgを各小容器に加え、培養液にラット肝抽出S9溶液を作用させたものと作用させないもので比較した。その結果、変異誘起剤のメチルスルホン酸や2−アミノアンスラセンと比べS9溶液の有無にかかわらず復帰変異誘導率は著しく低く、表1に示すように2-DCB濃度による影響は認められなかった。このことは、2-DCBは大腸菌変異株のトリプトファン復帰変異を誘発しないことを示している。
表1 大腸菌変異株のトリプトファン復帰変異による5%S9*肝抽出液有無での2-DCBの変異原性評価(原論文1の表を参考に作成)。
| |
|
2-DCB/トリプトファン復帰コロニー数 |
|
| 菌株 |
S9処理 |
0mg |
0.05mg |
0.10mg |
0.50mg |
1.00mg |
変異剤** |
| WP2(pKM101) |
− |
4.11±0.99 |
5.55±1.64 |
7.56±1.75 |
4.78±1.33 |
5.22±1.57 |
146±14.7 |
| WP2(pKM101) |
+ |
2.11±0.11 |
1.89±0.48 |
1.89±0.48 |
1.11±0.40 |
1.67±0.19 |
32.4±0.73 |
| WP2uvrA(pKM101) |
− |
8.11±2.73 |
6.33±3.23 |
7.00±2.52 |
9.00±2.65 |
8.44±3.23 |
141±9.45 |
| WP2uvrA(pKM101) |
+ |
9.22±1.27 |
8.44±2.50 |
9.44±2.50 |
8.67±0.69 |
9.22±0.69 |
116±2.67 |
| * S9処理液:ラット等の肝臓をすりつぶしたものに反応を補助する物質を添加した反応液であり、化学物質によってはS9処理液の代謝酵素の作用によって別の物質 に変換されてからDNAに作用して変異原性を示すものがある。
|
| ** 変異剤:メチルメタンスルフォン酸または2−アミノアンスラセン、復帰コロニー数は3回実験の平均値。
|
ネズミチフス菌として知られている細胞膜の透過性が高いサルモネラ・タイフィムリウム変異株による復帰変異はエームス試験法として25年以上にわたり国際的に遺伝毒性試験に用いられている。Sommersらが用いた変異株のうちTA98とTA1537株は変異原性物質の作用によって起こるDNA鎖断片を入れ替えるフレームシフト変異を検出でき、TA100とTA1535株は塩基対置換の点突然変異を検出できる。試験方法は大腸菌変異株と同様であり、表2に示すようにS9肝抽出液の有無にかかわらず変異原性は認められなかった。また、2-DCBの濃度が1.0mgの濃度でも菌の死亡は認められず、1.0mgの濃度は寒天培地1枚当たり5mgに相当した。このサルモネラでの復帰変異試験の結果は大腸菌変異株のトリプトファン復帰変異試験では得られなかったフレームシフト復帰変異での情報を与えてくれている。なお、Gadgilらもエームス菌を用いて同じような結果を得ている。
表2 サルモネラ変異株のエームス試験による5%S9抽出液有無での2-DCBの変異原性評価(原論文2の表を参考に作成)。
| |
|
2-DCB/ヒスチジン復帰コロニー数 |
|
| 菌株 |
S9処理 |
0mg |
0.05mg |
0.10mg |
0.50mg |
1.00mg |
変異剤 |
| TA98 |
− |
4.00±0.50 |
3.83±0.33 |
3.5±0 |
3.67±0.17 |
3.33±0.88 |
111±4.16 |
| |
+ |
3.33±0.44 |
2.33±0.67 |
1.83±0.33 |
2.00±0.29 |
2.83±0.17 |
92.2±3.25 |
| TA100 |
− |
16.2±1.64 |
16.2±1.30 |
19.2±0.67 |
17.0±0.76 |
16.8±1.83 |
159±8.26 |
| |
+ |
13.2±3.09 |
9.67±1.59 |
16.2±4.32 |
13.7±1.17 |
14.2±3.17 |
205±4.49 |
| TA1535 |
− |
3.50±0.29 |
1.50±0.29 |
2.17±0.17 |
2.83±0.17 |
3.50±0.76 |
126±4.07 |
| |
+ |
2.16±0.67 |
1.17±0.44 |
1.50±0.29 |
1.67±0.7 |
1.33±0.44 |
91.2±7.91 |
| TA1537 |
− |
2.00±0.29 |
1.83±0.44 |
2.00±0.76 |
2.17±0.17 |
1.33±0.60 |
54.4±5.84 |
| |
+ |
1.17±0.33 |
0.50±0.29 |
1.67±0.73 |
1.0±0.29 |
1.50±0.29 |
42.8±1.59 |
* 変異剤:S9処理が無しの場合はTA100とTA1535にはメチルメタンスルフォン酸、TA98とTA1537には2−ニトロフルオレンを用い、S9処理では全株とも2−アミノアンスラセンを用いた。復帰コロニー数は3回実験の平均値。
|
3.酵母菌変異株による染色体内組み替え試験と発光細菌による急性毒性試験
酒酵母菌のSaccharomyces cerevisiae変異株のRS112による染色体内組み替え試験はサルモネラのエームス試験では検出できない突然変異誘起可能または誘起不能の発癌物質を検出することができる。すなわち、DNAを酸化的に損傷したり酵素的に損傷する発癌性物質を検出可能である。Sommersらは2-DCBを0.63〜5.0mg/mlとなるように約106個濃度の酵母菌細胞懸濁液に作用させ、染色体内組み替え試験を行った。その結果、表3に示すように酵母菌の生存率は2-DCBの濃度が5.0mg/mlで28.5%まで低下したが、染色体内組み替えの比率は2-DCB未添加と大差がなく、染色体内組み替えを誘発しないことを明らかにした。このことは、2-DCBに発癌性がないことを示している。
表3 2-DCBによる酵母菌Saccharomyces cerevisiae RS112株の染色体内組み替え頻度(原論文2の表を参考に作成)。
| |
2-DCB濃度 |
MMS |
| |
0 mg/ml |
0.63 mg/ml |
1.25 mg/ml |
2.5 mg/ml |
5.0 mg/ml |
50 μg/ml |
| 組み替え頻度 |
0.72 x 10-4 |
0.97 x 10-4 |
0.62 x 10-4 |
1.01 x 10-4 |
1.04 x 10-4 |
16.7 x 10-4 |
| 標準偏差値 |
0.15 x 10-4 |
0.15 x 10-4 |
0.18 x 10-4 |
0.60 x 10-4 |
0.60 x 10-4 |
1.24 x 10-4 |
| 生存率(%) |
100 |
85.3 |
86.5 |
76.9 |
28.5 |
54.8 |
* 標準偏差値は3回の実験から得られた。MMSはメチルメタンスルフォン酸。
|
Gadgilらは2-DCBの急性毒性試験を行うために簡易法であるMicrotox急性毒性試験システムを用いて、海洋発光細菌のVibrio fischeri細胞検体存在下での蛍光強度の測定によって毒性を比較した。対象としては2-DCBと似たカルボニル化合物で食品添加剤であるサイクロヘキサノンと2−ノネナルを用いた。その結果、発光細菌細胞の蛍光量を50%減少させる濃度は2-DCBで平均21.72ppm(mg/kg)、サイクロヘキサノンで37.40ppm、2−ノネナルで1.65ppmであった。このことは2−ノネナルより2-DCBの方が毒性が低いことを示している。また、蛍光減少で影響を受けた最大細胞数は2-DCBで65%であったが、他の2剤では90〜100%であった。これらの結果から細胞の蛍光減少から見た毒性は2-DCBの方が他の2剤に比べ少ないことを示している。
4.大腸菌変異株のDNA損傷を誘導する遺伝子による変異原性試験
SommersとMackayはエームス試験等で得られた2-DCBの結果をさらに確認する目的で大腸菌変異株のDNA損傷を誘導する遺伝子による変異原性試験を実施した。
用いた変異株はSFI dinD:lacZ tn10:tolC、SFI recA:lacZ tn 10:tolC、SFI umuDC-lacZ tn10:tolC、SFI nfo-lacZ tn10:tolCの4株であり、DNA損傷誘導を検出できるβ−ガラクトシダーゼを誘導する遺伝子と細胞膜透過性を向上するDNA上を転移できる遺伝子を有している。変異株のdinD因子は変異原性物質によりDNA転写と再結合中間体の損傷に関与する遺伝子を誘導し、recAは遺伝子の欠失またはSOS(緊急事態変異)変異を誘起する遺伝子の誘導、umuDCはDNA転写を誤写する遺伝子の誘導、nfoは酸化的DNA損傷の修復に関与する遺伝子の誘導を行う。DNA損傷を誘導する遺伝子を有する変異株による変異原性試験は復帰変異試験では検出できないDNAのストレスを引き起こす変異原性物質を検出できるため、多く用いられてきた。
本試験では、2-DCBは125〜1000μg/ml添加しS9肝抽出液を作用させたものと作用させないもので比較した。その結果、表4に示すように2-DCBはS9肝抽出液の有無にかかわらず変異原剤の2−アミノアンスラセン等と比べβ−ガラクトシダーゼの活性が著しく低く、2-DCB濃度への依存性は認められなかった。
表4 2-DCBによる大腸菌変異株DNA損傷誘導遺伝子の誘導(原論文4の表を参考に作成)。
| |
|
2-DCB μg/ml |
|
| 判定株 |
S9処理 |
0 |
125 |
250 |
500 |
1000 |
変異剤 |
| dinD-lacZ |
− |
4.37±1.43 |
3.48±0.84 |
3.50±1.28 |
3.36±2.17 |
1.21±0.6 |
28.8±10.1 |
| |
+ |
5.11±0.30 |
2.08±0.79 |
1.74±0.65 |
1.69±0.62 |
4.80±2/03 |
54.4±17.5 |
| recA-lacZ |
− |
17.4±6.12 |
13.9±5.54 |
12.3±6.08 |
13.5±5.61 |
13.8±8.68 |
57.3±19.3 |
| |
+ |
7.55±1.9 |
5.27±1.21 |
4.50±1.67 |
5.23±1.24 |
4.51±1.15 |
65.1±5.67 |
| nfo-lacZ |
− |
3.95±1.77 |
3.58±0.85 |
2.83±0.44 |
1.84±0.40 |
21.0±9.01 |
87.7±20.5 |
| |
+ |
21.8±2.40 |
13.6±3.00 |
13.5±3.03 |
13.2±2.27 |
14.8±1.3 |
104±10.9 |
| umuDC-lacZ |
− |
9.89±2.91 |
10.6±3.07 |
9.86±3.77 |
10.4±4.13 |
10.6±5.25 |
57.1±11.2 |
| |
+ |
3.87±1.65 |
2.94±1.64 |
3.10±1.42 |
1.73±0.82 |
2.10±1.57 |
48.0±5.42 |
* β−ガラクトシダーゼ活性によって調べられた結果は3回の実験から得られた。S9処理が無いdinD、recA、umuDCの変異剤は130μg/mlのメチルメタンスルフォン酸で処理し、nfoは5μg/mlの4−ニトロキノロン−N−酸化物で処理した。S9処理は全て10μg/mlの2−アミノアンスラセンで処理した。
|
一方、大腸菌変異株のSF1は代謝によって5−フルオロウラシルを毒性物質に転換する能力があり、5−フルオロウラシル抵抗性株の出現誘導変異試験によって効率的にDNAの酸化損傷能を検出できる。本変異株を0.125〜1.0mg/ml(125〜1000μg/ml)の2-DCBに作用させたところ2-DCB濃度が1mg/mlで細胞の生存率が27%でも2−フルオロウラシル抵抗性コロニーの増加はなく、S9肝抽出液を添加してもコロニー形成の差は認められなかった。これらの結果は、2-DCBにはDNA損傷による変異の誘発や染色体内の組み換え能がないことを示している。すなわち、2-DCBには遺伝毒性がないことを示している。
コメント :
2-ACB類には2-DCB以外にも2−テトラデシルシクロブタノンや2−テトラデセニルシクロブタノン、2−デシルシクロブタノンなどがあり、いずれも組織培養細胞に高濃度で1〜2日作用させるとDNA鎖切断能があることが報告されている。しかし、ビタミンCやルチンなどにも同じような作用があることが知られている。一方、高濃度の2-ACB類には結腸癌を促進させる可能性があると報告されているが、ステアリン酸やオレイン酸などの脂肪酸類には癌抑制作用があり、実際の照射食品中では2-ACB類に比べそれらの脂肪酸の比率が圧倒的に高いため、問題になることはあり得ない。また、照射によって2-DCBを生成するパルミチン酸そのものにもDNA鎖切断能があるとの報告もあり、電気泳動によるDNA鎖切断の評価は変異原性試験としては不確実な試験法であることを示している。これらのことも考察すると、2-ACB類には変異原性がないことを示している。
原論文1 Data source 1:
2-Dodecylcyclobutanone does not induce mutations in the Escherichia coli tryptphan reverse mutation assay
C. H. Sommers
U.S. Department of Agriculture, Agriculture Research Service, Eastern Regional Research Center
J. Agric. Food Chem., 51, 6387-6370(2003).
原論文2 Data source 2:
2-Dodecylcyclobutanone does not induce mutations in the Salmonella mutagenicity test or interchromosomal recombination in Saccharomyces cerevisiae
C. H. Sommers* and R. H. Schiestl**
*U.S. Department of Agriculture, Agriculture Research Service, Eastern Regional Research Center, **Department of Pathology, Environmental Health and Radiation Oncology, David Geffen School of Medicine and School of Public Health
Journal of Food Protection, 67, 1293-1298(2004)
原論文3 Data source 3:
Mutagenicity and acute toxicity evaluation of 2-dodecylcyclobutanone
P. Gadgil and J. S. Smith
Food Science Inst., Dept. of Animal Science and Industry, 208 Call Hall, Kansas State Univ.
Journal of Food Science, 69, C713 - C716(2004)
原論文4 Data source 4:
DNA damage-inducible gene expression and formation of 5-fluorouracil-resistant mutants in Escherichia coli exposed to 2-dodecylcyclobutanone
C. H. Sommers* and W. J. Mackay**
*U.S. Dept. of Agriculture, Agriculture Research Service, Eastern Regional Research Center, **Edinbro Univ. of Pencylvania, Dept. of Biology & Health Services
Journal of Food Science, 70, C254 - C257(2005)
参考資料1 Reference 1:
Genotoxicity of 2-dodecylcyclobutanone, a compound formed on fat-containing food treated by ionizing radiation
H. Delincee, B.-L. Pool-Zobel and G. Rechlemmer
Institute of Nutritional Physiology, Federal Research Center for Nutrition, Germany
Final Report to ICGFI (Project 96 CT 2950)
参考資料2 Reference 2:
Genotoxicity of 2-alkylcyclobutanones, markers for an irradiation treatment in fat-containing food
H. Delincee, C. Soika and E. Marchioni
Institute of Nutritional Physiology, Federal Research Center for Nutrition, Germany
XII. IMRP, March 25 - 30, 2001, Avignon, France
参考資料3 Reference 3:
Food-borne radiolytic compounds (2-alkylcyclobutanones) may promote experimental colon carcinogenesis
F. Raul1), F. Gosse1), H. Delincee3), A. Hartwig4), E. Marchioni5), M. Miesch6), D. Werner7) and D. Burnouf2)
1)Laboratoire d'Oncologie Nutritionnelle, 2)Groupe d'Epidemiologie Moleculaire du Cancer, France, 3)Bundesforschungsanstalt für Ernährung, Germany 4) Institut für Lebensmittelchmie und Toxikologie, Universität Karlsruhe, Germany, 5)Laboratoire de Chimie Analytique et Siences de I'Aliment, Faculte de Phamacie, Universite Louis Pasteur, France, 6)Laboratoire de Chimie Organique Synthetique, Faculte de Chimie, Universite Louis Pasteur, France, 7)Aerial F-67300 Schiltighen, France
Nutrition and Cancer, 44, 188 - 191(2002)
キーワード:2−アルキルシクロブタノン類、2−ドデシルシクロブタノン、照射肉製品、変異原性、復帰変異、染色体内組み換え、点突然変異、フレームシフト変異、DNA損傷誘導遺伝子
2-alkylcyclobutanones, 2-dodecylcyclobutanone, irradiated meat products, mutagenicity, reverse mutation, genomic rearrangements, point mutations, frameshift mutations, DNA damage-inducible gene
分類コード:020405, 020403, 020404
