作成: 2003/08/05 林徹
データ番号 :020231
照射食品の抗原性
目的 :照射した食品蛋白質のアレルゲン性の検討
放射線の種別 :ガンマ線
放射線源 :60Co線源
線量(率) :7.5kGy/h
照射条件 :空気中、窒素中
応用分野 :食品の殺菌
概要 :
食品蛋白質を放射線照射すると、一般に蛋白質の高次構造が変化して抗体と結合できなくなり、アレルゲン性が低下する。また、照射により新たなアレルゲン性が認められたとしても、照射による立体構造変化に伴い内側に隠れていた部分が露出したためであり、元の蛋白質のアミノ酸配列が変化したものではない。
詳細説明 :
卵白アルブミン及び牛血清アルブミンをリン酸緩衝液に溶解してガンマ線を照射し、免疫拡散分析によりそれぞれの抗体に対する反応性を調べたところ、卵白アルブミンを窒素中で照射すると8kGy、酸素中で照射すると4kGyで反応性がなくなり、牛血清アルブミンでは窒素中、酸素中いずれの雰囲気下で照射しても4kGyで反応性が失われた。
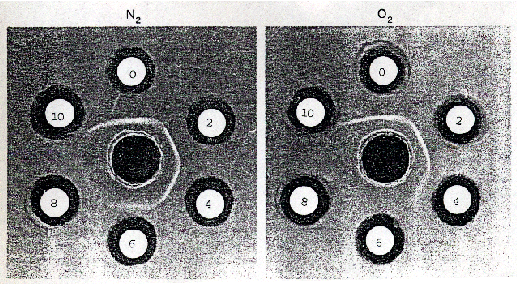
図1 Immunodiffusion of irradiated OVA. Antiserum was allowed to diffuse from the center well against the OVA irradiated at 2-10 kGy.(原論文1より引用)
照射した卵白アルブミンを電気泳動してイムノブロッティングを行うと、照射による卵白アルブミンの低分子化と高分子化が起こり、それぞれの画分が弱いながらも抗体への反応性を示すことがわかった。なお、抗原の検出技術の感度は、イムノブロッティングの方が免疫拡散分析よりも高い。
卵白アルブミンの示差熱分析及び円偏光二色性スペクトルから、ガンマ線照射により線量に依存して高次構造の変化が起こっていることが明らかになった。ガンマ線を100kGy照射した卵白アルブミンの5種類のモノクロナール抗体に対する反応性を調べたところ、4種類の抗体は非照射、照射いずれの卵白アルブミンにも反応したが、1種類の抗体は照射卵白アルブミンにしか反応しなかった。エピトープ分析により、この抗体が卵白アルブミン分子のVal173-Met196部位に反応性を示し、照射により新たなアミノ酸配列のペプチドが生成するのではなく、卵白アルブミンの立体構造変化あるいは分子の開裂が起こってこの部位が露出することがわかった。なお、このような構造変化に伴う新たな抗原部位の出現は、放射線照射だけでなく、加熱、尿素などによる変性によっても起こり、照射卵白アルブミンに反応する抗体はこれらの処理で変性させた卵白アルブミンにも反応した。これらの結果から、この抗原は、照射卵白アルブミン分子が変性することにより露出してくる部分であり、新たな抗原が生成するのではないことがわかる。
β-ラクトグロブリン、鶏の卵白アルブミン、エビのトロポミオシンをリン酸緩衝液に溶解してガンマ線を照射し、アレルギー患者の血液から得たIgEを用いて競合法ELISAによりアレルゲンを定量したところ、いずれも照射により線量に依存してアレルゲンが低下していた。その原因として、アレルゲンとなるエピトープの構造変化が起こり、IgEが認識できなくなったためと推察されている。
表1 Concentration (μg/mL) of gamma-irradiated food allergens detected by Ci-ELISA based with IgE in patients' sera.(原論文3より引用)
Irradiation
dose(kGy) |
Shrimp
tropomyosin |
Milk
BLG |
Egg
OVA |
0
3
5
10
|
10
5.34
4.21
3.35
|
10
3.52
1.12
0.36
|
10
1.95
0.36
0.03
|
エビに対するアレルギー患者のIgEは、エビのsarcoplasmic画分及びmyofibrillar画分のいずれに対しても、線量に依存して、結合能が低下した。
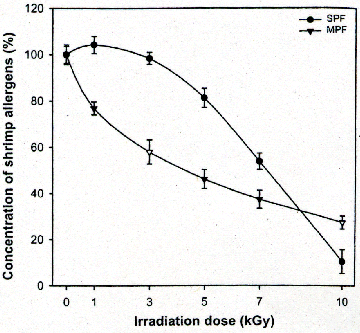
図2 Concentration of allergens in gamma-irradiated shrimp extracts detedted by shrimp-hypersensitive patients' IgE. The concentration was measured by CI-ELISA formatted with shrimp tropomyosin as standard allergen. SPF and MPF indicate sarcoplasmic protein and myofibrillar protein fraction, respectively.(原論文3より引用)
コメント :
食品蛋白質のアレルゲン性に対する照射の影響を検討したいくつかの論文を紹介したが、いずれにおいても照射によるアレルゲン性の低下が報告されている。その主要な原因は、照射により蛋白質の高次構造が変化して、抗体と結合できなくなることにある。また、卵白アルブミンにみられるように、たまたま照射により新たなアレルゲンが認められたとしても、照射による立体構造変化に伴い内側に隠れていた部分が露出したためであり、元の蛋白質のアミノ酸配列が変化したものではない。したがって、照射により新たなアレルゲンが生成する心配はない。
原論文1 Data source 1:
Changes in structural and antigenic properties of proteins by radiation
Tamikazu Kume, Tsukasa Matsuda
Takasaki Radiation Chemistry Research Establishment, Japan Atomic Energy Research Institute
Radiation Physics and Chemistry, 46, 225-231,(1995)
原論文2 Data source 2:
Characterization of anti-irradiation-denatured ovalbumin monoclonal antibodies. Immunochemical and structural analysis of irradiation-denatured ovalbumin
Tetsuya Masuda, Sakiyo-Yamaoka Koseki, Kyoden Yasumoto, Naofumi Kitabatake
Research Institute for Food Science, Kyoto University
Journal of Agricultural Food Chemistry, 48, 2670-2674 (2000)
原論文3 Data source 3:
Application of gamma irradiation for inhibition of food allergy
Myung-Woo Byun, Ju-Woon Lee, Hong-Sun Yook, Cheorum Jo, Hee-Yun Kim
Team for Radiation Food Science and Biotechnology, Korea Atomic Energy Research Institute
Radiation Physics and Chemistry, 63, 369-370 (2002)
参考資料1 Reference 1:
卵白アルブミンをモデルとした照射食品たんぱく質の免疫化学的性質
安本教傳
京都大学食糧科学研究所
食品照射研究委員会研究成果最終報告書、日本アイソトープ協会、(1992) pp.61-77
キーワード:タンパク質,放射線, 照射,卵白アルブミン, 牛血清アルブミン,アレルゲン,抗原性,抗体, protein, radiation,irradiation, ovalbumin, bovine serum albumin, allergen, antigenicity, antibody
分類コード:020405,020404

