作成: 1997/10/18 久米 民和
データ番号 :020029
放射線失活法による生物活性物質の分子サイズ測定
目的 :生体内活性物質の分子サイズの測定とその応用
放射線の種別 :ガンマ線,電子
放射線源 :60Co-γ線、電子加速器
線量(率) :10kGy-500kGy
利用施設名 :日本原子力研究所高崎研究所食品Co棟照射施設、2号加速器
照射条件 :真空中、室温〜液体窒素温度
応用分野 :生体機能研究、分子量計測、食品照射
概要 :
放射線失活法は、放射線を活性物質に照射したときに生ずる失活の程度から、活性物質の分子の大きさを測定する方法である。放射線失活法は、活性物質を可溶化したり、精製したりする必要がないという特徴を有し、生体内の活性物質の分子量が測定できる唯一のユニークな方法である。生体内での酵素やレセプター等の活性単位を測定し、機能解明への分野で応用されている。
詳細説明 :
従来、タンパク質の分子量測定法としては、沈降平衡法、光散乱法、SDS-ポリアクリルアミド電気泳動法、ゲルろ過法などの物理化学的方法が主に用いられてきた。しかし、これらの方法はいずれも、分子量を測定するために、単離、精製する必要があり、実際に生体内で作用している状態での分子量を測定することはできない。これに対し、放射線失活法は、活性物質を可溶化したり、精製したりする必要がないという特徴を有し、生体内の活性物質の分子量が測定できる唯一のユニークな方法である。この点に着目して、近年特に生体内での酵素やレセプター等の活性単位を測定し、機能解明へ応用することが試みられている。
1. 放射線失活法の概念 -標的説-
放射線失活法による分子量測定の概念は、1920年代に生物に対する放射線の作用を説明するために提唱されたターゲット(標的)説に基づいている。細胞内には、放射線に敏感な構造体が存在し、この構造体のどの部分に傷が一個できても、構造体は機能を失う。この構造体を"標的"(target)と呼び、標的の傷を"ヒット"(hit) と呼ぶ。標的が大きければ大きいほどヒットされ易く、失活しやすいということになる。ヒット事象は互いに独立でアットランダムに分布し、ポアソンの分布公式に従うとすると、標的中にヒットのおこらない確率は、
P(0) = e-kD (1)
従って、N0個体のうち線量 Dによってもなおヒットを受けない個体数(生残数)N は、
N = N0 e-kD または ln N/N0 = -kD (2)
式(2)のkは、ln N/N0を線量Dに対してプロットしたときに得られる直線の傾きであり、「不活化係数」または「不活性化断面積」と呼ばれる。kD=1 すなわち D=1/k となる線量を与えたとき、
N/ N0 = e-1= 0.37 (3)
すなわち、元の活性の 37%となり、この線量を「平均失活線量」と呼ぶ。この D37線量を用いて、次の経験式3)から活性物質の分子サイズ(いわゆる分子量に相当:Mr)が計算できる。
Mr = 6.4 x 106 / D37(kGy) (4)
標的説は、細菌や酵母細胞の致死、ウイルスや酵素の失活、ショウジョウバエの染色体異常の研究に適用された。しかし、照射後の回復や修復過程が明らかになるにつれて、多くの生物現象に当てはめることが難しいことがわかり、標的説で生物に対する放射線の作用を説明しようという考えは余り省みられなくなった。しかし、小さなウィルスや酵素の場合、指数関数的な失活曲線が得られ、標的説に基づいて求めた分子量が従来法で求められている値とよく一致することが明らかにされている。とくに、Kempner らにより、放射線失活法による分子量測定法の有効性と応用例がまとめられて以来、多くの研究者によって応用されるに至っている。
2. たん白質の機能解析への応用例
タンパク質分解酵素トリプシンのインヒビターの分子サイズについて、放射線失活法を用いて検討した結果、分子量とは異なる結果が得られた(図1、表1)。
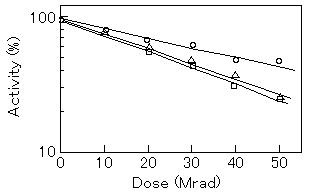
図1 Radiation inactivation of three trypsin inhibitors.Purified trypsin inhibitors were lyophilized,sealed in vacuo and irradiated at room temperature. The lines,○,ovomucoid;□,ovoinhibitor;△soybean trypsin inhibitor,represent data analyzed by the method of least squares constrained to 100% at zero dose. (原論文2より引用。 Reproduced from Biochim. Biophy. Acta, 914, 101 (1987), Fig.1(p.102),T. Kume and I. Ishigaki, Functional molecular size of trypsin inhibitors as determined by radiation inactivation analysis; Copyright(1987), with permission from Elsevier Science.)
表1 Molecular weight obtained by radiation inactivation and HPLC analysis. Molecular weight(Mr)was calculated from D37 dose as described in the text.(原論文2より引用。 Reproduced from Biochim. Biophy. Acta, 914, 101 (1987), Tab1(p.102), with permission from Elsevier Science.)
-------------------------------------------------------------------
Radiation inactivation
MW HPLC D37(kGy) Target size
-------------------------------------------------------------------
Ovomucoid 28,000 55,000 627 10,200±700
Ovoinhibitor 49,000 55,000 360 17,800±400
Soybean trypsin 20,000 19,500 390 16,400±500
inhibitor
-------------------------------------------------------------------
これらの値は各インヒビターの活性ドメインの大きさにほぼ一致しており、放射線失活法では従来法よりも詳細な活性領域を測定できることが示された。また、血圧の制御に関係する心臓ホルモンである心房性ナトリウム利尿ペプチド(ANP)、レセプター(Rc) 及び酵素グアニル酸シクラーゼ(GC)の間の相互作用について、放射線失活法により次に示す反応機構が明らかとなった。
Rc・GC(不活性) + ANP → Rc・ANP + GC(活性)
即ち、結合状態で不活性であったGCが、Rcが信号ANP と結合することによって、フリーとなって活性を示すという解離のメカニズムが推定された。このように、放射線失活法は、生体情報システム等生体内での種々の作用機構解明のための有効な一手段となり得る。
コメント :
放射線失活法は、活性物質を可溶化や精製を行わずに、生体内の活性物質の分子サイズが測定できる唯一のユニークな方法である。従って、生体内でのタンパク質の機能サイズというまったく異なる知見が得られることから、他の方法で得られる情報と組み合わせることにより、生体の機能解明の進展に寄与できることが期待される。一方、タンパク分子の糖鎖の影響、サブユニット構造と放射線失活法で得られる活性ユニットの大きさとの関係など、今後さらに詳細な検討を要する点も残されている。
原論文1 Data source 1:
放射線失活法による生物活性物質の分子サイズ測定
久米 民和
日本原子力研究所高崎研究所、〒370-12 高崎市綿貫町1233
放射線化学、No.57, p3 (1994)
原論文2 Data source 2:
Functional molecular size of trypsin inhibitors as determined by radiation inactivation analysis
T. Kume and I. Ishigaki
Takasaki Radiation Chemistry Research Establishment, Japan Atomic Energy Research Institute, Takasaki, Gunnma, Japan
Biochim. Biophy. Acta, 914, 101 (1987)
原論文3 Data source 3:
Inhibition of Atrial Natriuretic Peptide-induced Cyclic GMP Accumulation in the Bovine Endothelial Cells with Anti-atrial Natriuretic Peptide Receptor Antiserum
M. Ishido, T. Fujita, M. Shimonaka, T. Saheki, S. Ohuchi, T. Kume*, I. Ishigaki* and S. Hirose
Department of Biological Sciences, Tokyo Institute of Technology, Ookayama, Meguroku, Tokyo 152, * Takasaki Radiation Chemistry Research Establishment, Japan Atomic Energy Research Institute, Takasaki, Gunnma, Japan
J. Biol. Chem., 264, 641 (1989)
参考資料1 Reference 1:
E. S. Kempner and W. Schlegel
Anal. Biochem., 92, 2 (1979)
参考資料2 Reference 2:
E. S. Kempner
Adv. Enzymol., 61, 107 (1988)
参考資料3 Reference 3:
E. S. Kempner and S. Fleischer
Methods Enzymol., 172, 410 (1989)
キーワード:放射線、失活法、分子量、分子サイズ、標的説、生物活性物質、酵素、レセプター
radiation, inactivation, molecular weight, molecular size, target theory, bioactive materials, enzyme, receptor
分類コード:020304, 020403
