作成: 1998/10/30 谷田貝 文夫
データ番号 :150004
突然変異の解析:多重PCR法とcDNA塩基配列決定法の併用
目的 :放射線により誘発される突然変異の解析手法の開発
研究実施機関名 :理化学研究所 細胞生理学研究室 ラジオアイソトープ技術室
応用分野 :放射線生物学、分子遺伝学
概要 :
理研リングサイクロトロンにより加速した炭素イオンをその線エネルギー付与(LET)を種々に変えてヒト胎児初代培養細胞に照射し、ヒポキサンチンリボシル転移酵素(HPRT)遺伝子座に誘導される突然変異のLET依存性について詳細な解析を行った。HPRT変異の質的な解析には変異細胞のゲノムDNAに対する多重PCR法とメッセンジャーRNAから合成したcDNAに対する塩基配列決定法の併用が有効であることを指摘した。
詳細説明 :
1.突然変異誘発研究の意味
放射線の生物影響のなかで、われわれの子孫にまでも重要な影響をおよぼすと考えられる遺伝的影響に限って調べるとしても、DNA損傷、突然変異、染色体異常、遺伝子発現異常、細胞分化異常、細胞分裂遅延、細胞増殖異常、細胞死など多種多様な指標が考えられる。このように数あるなかで、突然変異が有効な指標の一つとして注目されるのは、 突然変異は発癌、遺伝的疾病、老化の原因と考えられているからである。これらの原因究明には、突然変異のタイプ(塩基置換、フレームシフト、欠失変異)や遺伝子上での誘発部位を決定する必要がある。
そこで、 突然変異を迅速・簡便に検出し、分子レベルで詳細に解析しうる系の構築が大切になる。放射線による被ばくを考えると、放射線の種類やそのエネルギーにより誘発される突然変異のタイプなどが変わる。すなわち、質的相違が生じる可能性が高い。この可能性を明らかにできるような突然変異解析系の構築を目指して「放射線により誘発される突然変異の特異性に関する研究」というテーマでプロジェクト研究を進めてきた。将来的には、このような研究が医療機関や核燃料に携わる従事者などの健康管理を含めて幅広く放射線のリスク評価につながることを期待している。ここでは、放射線による突然変異の解析系として有効と思われる手法を紹介する。
2.重イオンビームによる突然変異の誘発
ヒト胎児初代培養(HE)細胞に対して理研リングサイクロトロンによって加速した炭素イオンビームを、照射位置でLET(線エネルギー付与)が 22, 39, 68, 75, 110, 124, 148, 230 keV/μmになるように調節して照射し、細胞の致死とヒポキサンチンリボシル転移酵素(hprt)遺伝子座における突然変異について調べた。その結果は図1に示すように、致死、変異誘発の両相対効率(RBE)ともLETが120 keV/μm付近で最も効率よく起こることが明らかになった。この結果はこの細胞だけに特有な現象ではなく、ほかの哺乳類培養細胞でも同様の傾向を示すことが明らかになっている。
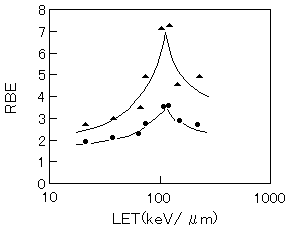
図1 細胞死(●)およびHPRT突然変異(▲)を引き起こす相対的効率(RBE)のLET依存性(原論文1より引用。 Reproduced from Adv. Space. Res. 1996; 18, 127-136, Fig.3(p.130), Suzuki M, Watanabe M, Kanai T, Kase Y, Yatagai F, Kato T, and Matubara S., LET Dependence of Cell Death, Mutation Induction and Chromatin Damage in Human Cells Irradiated with Accelerated Carbon Ions, Copyright(1995), with permission from Elsevier Science. )
3.突然変異誘発を詳細に解析する手法
1)多重PCR法
得られたHPRT(-)突然変異体細胞からゲノムDNAを抽出して、多重PCR法(図2)により突然変異の解析を試みた。多重PCR法とは、広大な特定の遺伝子座領域のなかで複数のエクソン(HPRTでは9つのエクソン)領域を1本の試験管内で同時に増幅する方法で、PCRとはPolymerase Chain Reactionの略でDNA複製酵素によって同じ塩基配列のDNA鎖を増幅生成する反応のことである。各エクソン領域にHPRT酵素を構成するアミノ酸配列の情報がとびとびに入っているので大変重要である。図1でRBEピークを与えるLET120 keV/μmでは、ゲノムDNA上でエクソン領域が欠損しているHPRT(-)変異体が多く得られたのに対して、それより高いLET 230 keV/μmでは、エクソン領域が保持されているという大変興味深い結果が得られた(図2)。

図2 ヒト胎児細胞におけるHPRT(-)変異の多重PCR法による解析:アガロースゲル電気泳動パターン(原論文1より引用。 Reproduced from Adv. Space. Res. 1996; 18, 127-136, Fig.9(p.133), Suzuki M, Watanabe M, Kanai T, Kase Y, Yatagai F, Kato T, and Matubara S., LET Dependence of Cell Death, Mutation Induction and Chromatin Damage in Human Cells Irradiated with Accelerated Carbon Ions, Copyright(1995), with permission from Elsevier Science. )
2)cDNAシーケンス法
これら LET 230 keV/μmで得られたHPRT(-)変異体からmRNAを抽出し、mRNAを鋳型にしてcDNA(HPRT酵素のアミノ酸配列に対応している)を合成し、そのDNA塩基配列の決定を行なった。自然突然HPRT(-)変異体(細胞に放射線など特別の処理をしなくても培養しているだけで出現する低頻度の変異体)に対する同様の解析と比較検討をした(表1)。LET 230 keV/μmの炭素イオンによる多くの変異体はcDNA上でエクソン6あるいはエクソン6と8の両方を欠失(Skipping)していて、点突然変異が多く観察される自然突然変異体の変異集団とは全く異なった傾向を示している。なお、Skipping変異はmRNAのスプライシング異常によって誘発された可能性が高い。
表1 ヒト胎児細胞の炭素イオン(LET 230 keV/μm)照射による突然変異と自然突然変異との比較(原論文2より引用)
-------------------------------------------------------------
誘発頻度
-------------------------------------------------------------
突然変異の分類 炭素イオン(230keV/μm) 自然突然変異
-------------------------------------------------------------
塩基置換 2(11%) 5(50%)
フレームシフト 0 2(20%)
ミッシングa) 16(89%) 2(20%)
エクソン6 10 0
エクソン6 and 8 6 0
エクソン2 and 3 0 2
未同定(点突然変異) 0 1(10%)
-------------------------------------------------------------
合計 18(100%) 10(100%)
-------------------------------------------------------------
コメント :
検出感度の都合上、DNA損傷として同定することが不可能な場合でも、突然変異として検出されれば、原因となったもとの損傷を推測できる。また、突然変異の解析結果から遺伝子の機能異常などに関与する情報が得られるので、放射線による影響を病的疾患レベルで推測することにも貢献できる。いずれにしても、遺伝子に起きる突然変異の簡便かつ迅速な検出法の開発さらには遺伝的形質を介さない突然変異検出法の開発は関連基礎研究の進展とリスク評価などへの応用の両面から期待される。
原論文1 Data source 1:
LET Dependence of Cell Death, Mutation Induction and Chromatin Damage in Human Cells Irradiated with Accelerated Carbon Ions
Suzuki M, Watanabe M, Kanai T, Kase Y, Yatagai F, Kato T, and Matubara S.
National Institute of Radiological Sciences, Nagasaki University, The Institute of Physical and Chemical Research, Osaka University, and Yokohama City University
Adv. Space. Res., 18, 127-136 (1996)
原論文2 Data source 2:
Analysis of Mutations in the Human HPRT Gene Induced by Accelerated Heavy-Ion Irradiation
Kagawa Y, Yatagai F, Suzuki M, Kase Y, Kobayashi A, Hirano M, KatoT, Watanabe M, and Hanaoka F.
The Institute of Physical and Chemical Research, Toray Research Center Inc., National Institute of Radiological Sciences, Osaka University, and Nagasaki University
J. Radiat. Res., 36, 185-195 (1995)
キーワード:重イオン照射, 線エネルギー付与率、ヒト胎児初代培養細胞、ヒポキサンチンリボシル転移酵素変異、多重PCR、DNA 塩基配列決定
Heavy-ion, Linear Energy Transfer(LET), human embryo cell, HPRT Mutation, Multiplex PCR, DNA Sequencing
分類コード:150101, 150302

