原子力基盤技術データベースのメインページへ
作成: 1997/12/25 山田 清美
データ番号 :150003
放射線による染色体切断の検出技術の改良と開発
目的 :放射線によるDNA損傷の検出技術の開発
研究実施機関名 :国立国際医療センター研究所
応用分野 :放射線生物学、放射線治療学
概要 :
放射線誘発による染色体異常の検出のために、分子交雑蛍光(Fluorescence In Site Hybridization, FISH)法を採用して、被曝線量推定法のための精度と信頼性を検討した。その結果、分子交雑による染色体着色法は、従来の二動原体法による方法より、異常の検出精度が高く、顕微鏡による分析時間が 1/10以下で済み迅速で簡便な方法であることが判明した。この検出法を被曝線量推定法に利用する場合には、分析対象とする標的染色体の番号を統一することが必要であろうと提言した。
詳細説明 :
1.染色体着色法による染色体異常の新しい検出法
FISH法を利用した染色体着色法により標的染色体を蛍光着色して識別し、その構造異常を迅速で正確に同定することができる。その原理は、ビオチン標識の染色体番号に特異的なDNAプローブを熱処理して1本鎖化し、染色体DNAも熱処理して1本鎖化する。DNAプローブ液を染色体スライドの上にのせて封入し1晩ハイブリダイズすると、プローブDNAは相補性の塩基配列のところで2本鎖となり結合する。アビジン-FITC(Fluorescein Isothiocyanate)蛍光検出法により、標的染色体はFITCによって緑色に着色され、カウンター染色した他の染色体と容易に識別することができる。我々は、高精度の染色体着色法を開発している。
2.検出される染色体異常型
正常人の末梢血液を採取しX線を照射した後、通常の方法で血液培養する。放射線誘発による染色体異常の解析のための標本は、第一回目の分裂細胞を分析しなければならないので、培養時間は50時間とした。放射線誘発による染色体の形態異常を染色体着色法を用いて識別し、異常をスコアーする。その主な異常型を図1に示した。構造異常の中の大部分は単純な転座型に属する相互転座と二動原体染色体である(a〜e)。我々は、この転座型の切断を指標として、染色体異常率を求めて線量との相関を調べた。
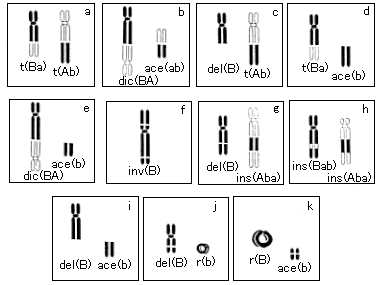
図1 放射線によって誘発される染色体のいろいろな構造異常型を示している。分子交雑法によって蛍光着色された標的の染色体を黒色で示す。a〜e型が観察の大部分を占めている。(原論文1より引用)
3.染色体の切断頻度と染色体の長さ(DNA量)
染色体の切断の頻度は染色体の長さに従って正確に比例するかどうかを検討した。3 grey 照射された同一材料からの標本について、染色体1、4、5、9、11、13番の染色体における細胞当たりの切断個数を調べて染色体DNA量との相関を調べた。図2のグラフは、放射線によって誘発された染色体の切断個数が染色体に含まれるDNA量とよく相関することを示している。
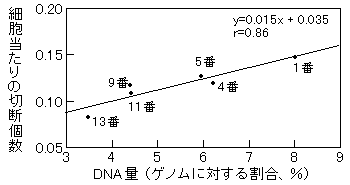
図2 同一の被曝線量(X線 3grey、ヒトのリンパ球)では、染色体の切断頻度は染色体の長さ(DNA量)に比例することを示している(1, 4, 5, 9, 11, 13番は分析対象とした染色体番号)。(原論文1より引用)
しかし、詳細に検討してみると、短い染色体が長い染色体よりも切断頻度が高いという逆の結果も得られた。 そこで、染色体の長さがあまり違わなくてバンドパターンが異なる染色体を選んで詳細に比較してみた。5 greyX線照射した細胞で、比較的にGバンド量が多い13番染色体とRバンド量が多い15番染色体を選び切断頻度を比較してみた(図3)。
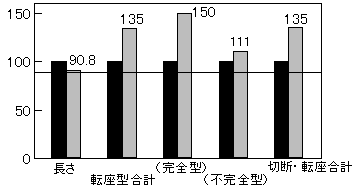
図3 染色体切断率を、染色体の長さは接近しているがバンドパターンが異なる2個の染色体間で比較した場合の例。左側は13番染色体で右側は15番染色体、左の値を100とした時の相対値。切断頻度は明らかに15番染色体の方が13番より高い傾向を示している(完全型と不完全型は、図1のa, bとc, d, e型に対応する)。(原論文1より引用)
DNA量は13番染色体を100とすると15番は90.8であるが、転座切断点および総切断点を比較してみると、明らかに15番染色体の方が切断頻度が高いことが明らかになった。3 grey照射した4番と5番染色体の比較においても、5番染色体の方が少し高いという同様の結果が得られている。したがって、個々の染色体のRバンドの量の違いによって、放射線に対する感受性が染色体によって少し異なると推測される。その原因は、細胞休止核におけるクロマチン繊維がバンドにより粗密の状態が異なることに関連しているのではないかと考えている。
以上の結果から、この新しい検出法は従来の方法より優れており、精度も高いことが明らかになった。また、染色体の部位によっては、DNA修復の際に誤りやすいバンド部分があることが明らかになったので、線量推定の場合には検出に使う標的染色体の番号を統一すべきであろうと提言した。
コメント :
分子交雑法による標本作製において、DNA熱変性やシグナル増幅やスライド洗浄などの処理は手操作で行っている。DNA試薬が高価であり、マイクロリットル単位の反応液でカバーガラスを使用して封入と染色を頻回に行っており、省力化と標本量産化は困難である。
原論文1 Data source 1:
放射線による染色体異常の自動解析のための標本作製法に関する研究
山田 清美
国立国際医療センター研究所
原子力工業, 42(7), 23-27(1996)
原論文2 Data source 2:
CHROMOSOME ABERRATIONS DETECTED BY CHROMOSOME PAINTING IN LYMPHOCYTES FROM CANCER PATIENTS GIVEN HIGH DOSES OF THERAPEUTIC X-RAYS.
Matuoka A, Yamada K, Hayashi M, and Sofuni T.
National institute of Health Science, and Research Institute, International Medical Center of Japan, Tokyo.
J. Radiat. Res., 37, 257-265(1996)
キーワード:分子交雑蛍光法、染色体着色法、被爆線量推定法、
FISH (fluorescence in situ hybridization), chromosome painting method, biological dosimetry
分類コード:150101, 150102, 150203
原子力基盤技術データベースのメインページへ

